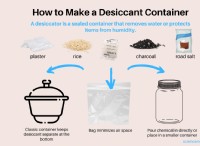
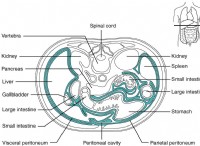
1. 이온 결합 :
* 형성 : 전자의 전달로 인해 금속과 비금속 사이에 발생하여 반대 전하로 이온을 형성합니다.
* 특성 : 이온들 사이의 강한 정전기 인력으로 인해 융점이 높은 단단하고 부서지기 쉬운 결정을 만듭니다.
* 예 : 염화나트륨 (NaCl), 불소 (CAF2), 요오드 화 칼륨 (KI)
2. 공유 결합 :
* 형성 : 원자가 전자를 공유 할 때 비금속 사이에 발생합니다.
* 특성 : 강한 결합으로, 단단하고 고갈 지점 결정을 초래합니다. 매우 방향성이 높아서 복잡한 결정 구조로 이어질 수 있습니다.
* 예 : 다이아몬드 (C), 실리콘 이산화물 (SIO2), 석영 (SIO2)
3. 금속 결합 :
* 형성 : 전자가 결정의 모든 원자들 사이에서 전자가 비편 재화되고 공유되는 금속 원자 사이에서 발생합니다.
* 특성 : 강한 유대, 가단성, 연성 및 열과 전기의 우수한 도체를 초래합니다.
* 예 : 금 (au), 구리 (Cu), 철 (Fe)
4. 반 데르 발스 세력 :
* 형성 : 전자 분포의 변동으로 인한 분자 또는 원자 사이의 약하고 일시적인 관광 명소.
* 특성 : 약한 결합으로, 부드럽고 낮은 멜팅 포인트 결정을 초래합니다.
* 예 : 고체 고귀한 가스 (He, NE, AR), 요오드 (I2)
5. 수소 결합 :
* 형성 : 수소 원자 사이의 특수한 유형의 쌍극자 원자 상호 작용은 (산소 또는 질소와 같은) 고 전기 음성 원자에 공유 결합 및 다른 전기 음성 원자에 공유 결합된다.
* 특성 : 상대적으로 강하지 만 여전히 이온 성 또는 공유 결합보다 약합니다. 생물학적 시스템에 중요합니다.
* 예 : 물 (H2O), 얼음, DNA
중요한 참고 :
* 많은 결정은 이러한 결합의 조합을 가질 수있어 고유 한 특성에 기여할 수 있습니다.
* 결합의 강도는 녹는 점, 경도 및 전기 전도성과 같은 많은 특성에 영향을 미칩니다.
구체적인 예를 탐색하거나 이러한 채권 유형에 대해 자세히 설명하려면 알려주십시오.