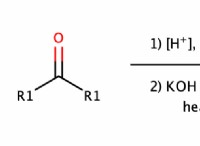
이유는 다음과 같습니다.
* 동결 지점 우울증 : 용액의 동결점은 순수한 용매의 동결 지점보다 낮습니다. 이 차이를 동결 지점 우울증이라고하며 용질의 몰에 직접 비례합니다.
* molality : 몰은 용매 킬로그램 당 용질의 두더지의 수이다.
* 용매 문제 : 동결 지점 우울증 상수 (KF)는 용매의 특성입니다. 예를 들어, 물의 KF는 1.86 ° C/m입니다.
이 문제를 해결하는 방법은 다음과 같습니다.
1. 용매를 식별하십시오 : 용매 (예 :물, 에탄올)를 진술하십시오.
2. 몰도를 계산합니다 :
* Niso₄의 질량을 몰로 변환하십시오 (몰 질량 사용).
* 니소의 두더지를 킬로그램에서 용매의 질량으로 나눕니다.
3. 동결 지점 우울증 계산 :
* 용매의 kf에 몰라도를 곱하십시오.
4. 순수 용매의 동결 지점에서 동결 지점 우울증을 빼냅니다.
* 순수한 물의 동결 지점은 0 ° C입니다. 계산 된 동결 지점 우울증을 0 ° C에서 빼서 용액의 동결 지점을 찾으십시오.
예 :
21.6g의 Niso₄가 500g의 물에 용해된다고 가정 해 봅시다.
1. 용매 : 물
2. 몰 리티 :
* Niso of의 두더지 =21.6 g / 154.75 g / mol =0.14 mol
* 물 질량 =500 g =0.5 kg
* molality =0.14 mol / 0.5 kg =0.28 mol / kg
3. 동결 지점 우울증 :
* ΔTF =KF * Molality =1.86 ° C/M * 0.28 M =0.52 ° C
4. 용액의 동결 지점 :
* 동결 지점 =0 ° C -0.52 ° C =-0.52 ° C
솔루션에 대한 정보와 솔루션의 올바른 동결 지점을 얻으려면 금액을 제공하십시오.