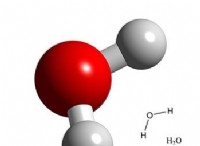
이온 성 화합물 대 공유 화합물
* 이온 성 화합물 : 이들은 반대로 하전 된 이온 사이의 정전기 인력에 의해 형성된다. 이 공식은 전기 중립성을 달성하는 데 필요한 이온의 가장 간단한 비율을 나타냅니다 (예를 들어, 모든 염화물 이온 (Cl-)에 대해 NaCl- 하나의 나트륨 이온 (Na+)).
* 공유 화합물 : 이들은 원자 사이에 전자를 공유함으로써 형성됩니다. 공식은 분자에 존재하는 각 요소의 실제 원자 수를 나타냅니다.
공유 화합물 공식을 작성하는 방법
1. 요소를 식별하십시오 : 화합물에 관련된 원소 (예 :탄소 및 산소)에 주목하여 시작하십시오.
2. 접두사를 결정하십시오 : 공유 화합물은 접두사를 사용하여 분자에서 각 요소의 원자 수를 나타냅니다. 다음은 몇 가지 일반적인 접두사입니다.
* 모노 -1
* di -2
* tri -3
* Tetra -4
* 펜타 -5
* 헥사 -6
* Hepta -7
* 옥타 -8
* Nona -9
* DECA -10
3. 공식을 작성하십시오 : 접두사를 사용하여 각 요소의 원자 수를 나타냅니다. 전기성이 낮은 요소는 일반적으로 먼저 작성됩니다.
예 :
* 이산화탄소 : 하나의 탄소 원자 (C) 및 2 개의 산소 원자 (O). 공식 :co₂
* 물 : 2 개의 수소 원자 (H) 및 1 개의 산소 원자 (O). 공식 :h .o
* 트리 플루오 라이드 : 하나의 질소 원자 (N) 및 3 개의 불소 원자 (F). 공식 :nf₃
중요한 참고 : 공유 화합물 공식을 작성할 때, 첫 번째 요소에는 해당 요소의 원자가 하나만 있으면 접두사가 없습니다.
더 많은 사례로 연습하고 싶다면 알려주세요!