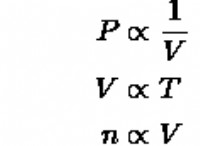1. 원자가 전자 수
* h : 1 원자가 전자
* c : 4 원자가 전자
* cl : 7 원자가 전자 (x2) =14 원자가 전자
* f : 7 원자가 전자
* 총 : 1 + 4 + 14 + 7 =26 원자가 전자
2. 중앙 원자를 결정하십시오
* 탄소 (C)는 가장 전기 음성 요소이며 중심 원자가 될 것입니다.
3. 원자를 단일 결합으로 연결하십시오
* 탄소를 수소, 2 개의 염소 및 불소를 단일 결합으로 연결하십시오. 이것은 8 개의 원자가 전자 (4 개의 결합 x 2 전자/결합)를 사용합니다.
4. 남은 전자를 분배하십시오
* 18 개의 전자가 남았습니다 (26-8).
* 각 염소 원자 주위에 6 개의 전자를 놓고 옥셋을 완성합니다 (각 CL에서 3 개의 고독 쌍). 이것은 12 개의 전자를 사용합니다.
* 불소 원자 주위에 6 개의 전자를 넣어 옥트 (F의 3 개 쌍 쌍)를 완성하십시오. 이것은 6 개의 전자를 사용합니다.
5. 옥트 규칙 이행을 확인하십시오
* 탄소에는 8 개의 전자 (4 개의 결합)가 있으므로 옥셋이 가득합니다.
* 염소에는 8 개의 전자 (1 개의 결합 + 3 론 쌍)가 있으므로 옥셋이 가득합니다.
* 불소에는 8 개의 전자 (1 개의 본드 + 3 론 쌍)가 있으므로 옥셋이 가득합니다.
* 수소에는 2 개의 전자 (1 결합)가 있으므로 듀엣이 가득합니다.
루이스 구조 :
```
시간
|
기음
/ | \
cl f cl
```
참고 : 이것은 단지 하나의 가능한 공명 구조 일뿐입니다. 실제 분자는 공명 하이브리드이며, 이는 이중 결합이 탄소와 각 할로겐 사이에 비편성됩니다.