이유는 다음과 같습니다.
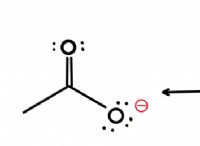
* 구조 : CO2는 탄소 원자와 각각의 산소 원자 사이에 2 개의 이중 결합을 갖는 선형 구조를 갖는다.
* 본딩 : CO2의 이중 결합은 탄소와 산소 원자 사이의 전자 공유에 의해 형성된다. 각 원자는 각 결합에 하나의 전자를 기여하여 모든 원자가 안정적인 옥트 구성을 달성하는 상황을 만듭니다.
공유 결합 (좌표 결합) :
*이 유형의 결합은 하나의 원자가 공유 쌍에 두 전자를 제공 할 때 발생합니다. 그것은 종종 고독한 쌍을 가진 분자와 빈 궤도가있는 분자 사이에서 발생합니다.
* CO2에서, 탄소 및 산소 원자는 전자를 동일하게 공유하는 데 관여하며, 단일 원자는 두 전자를 기증하지 않습니다.
공유 공유 결합의 예 :
* 암모니아 (NH3) 및 붕소 트리 플루오 라이드 (BF3) : 암모니아는 질소 원자에 고독한 전자 쌍을 가지고 있으며, BF3은 붕소 원자에 빈 궤도를 갖는다. 질소 원자는 두 전자를 붕소 원자에 기증하여 공유 결합을 형성합니다.
요약하면, CO2는 탄소와 산소 원자 사이의 이중 결합이 전자의 동일한 공유에 의해 형성되기 때문에 공유 공유 결합이 없습니다.