* 화학적 특성 : 원자가 전자는 원자가 다른 원자와 어떻게 상호 작용하는지 결정합니다. 원자는 안정적인 전자 구성 (일반적으로 전체 외부 쉘)을 달성하기 위해 원자가 전자를 얻거나 잃거나 공유하는 경향이 있습니다. 이것은 원자가 형성되는 결합 유형 (이온, 공유, 금속)을 지시합니다.
* 산화 상태 : 원자가의 원자가 전자의 수는 전형적인 산화 상태에 영향을 미치며, 이는 화합물에 전달되는 전하입니다.
* 반응성 : 원자가 전자가 적은 원자는 외부 껍질을 완성하기 위해 전자를 얻거나 공유 할 가능성이 높기 때문에 더 반응성이 높습니다. 반대로, 외부 껍질이 완전한 원자 (고귀한 가스)는 매우 반응하지 않습니다.
* 주기성 : 주기율표의 기간 (행)을 가로 질러 이동함에 따라 원자가 전자의 수가 증가합니다. 그렇기 때문에 동일한 그룹 (컬럼) 내의 요소가 동일한 수의 원자가 전자를 갖기 때문에 유사한 화학적 특성을 갖는 이유입니다.
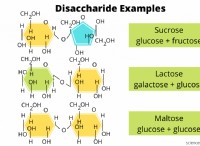
* 결합 용량 : 원자가 전자의 수는 원자가 일반적으로 형성 될 수있는 몇 개의 결합 수를 결정합니다. 예를 들어, 탄소는 4 개의 원자가 전자를 가지며 4 개의 결합을 형성 할 수 있습니다.
요컨대, 원자가 전자는 원자의 화학적 거동, 결합을 형성하는 경향 및 전반적인 반응성에 대한 중요한 정보를 제공합니다. 그것들은 방대한 화학 반응과 분자의 형성을 이해하는 데 필수적입니다.