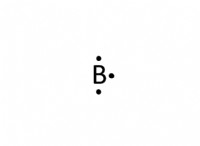간단한 그림을 그릴 수없는 이유 :
* 이온 성 화합물은 분자가 아닙니다 : Libr와 같은 이온 성 화합물은 개별 분자로 만들어지지 않습니다. 대신, 그들은 결정이라고 불리는 거대한 반복 격자 구조를 형성합니다.
* 공유 결합 없음 : 공유 결합에 의해 함께 보유 된 분자와 달리, 이온 성 화합물은 양으로 하전 된 이온 (양이온)과 음의 하전 된 이온 (음이온) 사이의 정전기 인력에 의해 함께 유지된다.
libr을 나타내는 방법 :
1. 루이스 도트 다이어그램 : Lewis Dot 다이어그램을 사용하여 전자의 전달을 보여줄 수 있습니다.
- 리튬 (li)에는 1 개의 원자가 전자가 있습니다.
- 브롬 (BR)에는 7 개의 원자가 전자가 있습니다.
- 리튬은 전자를 잃어 LIA가됩니다.
- 브롬은 전자를 얻기 위해 전자를 얻습니다.
- 다이어그램은 단일 점으로 Li와 7 개의 도트가있는 BR을 보여준 다음 Li에서 Br로 전달하여 li ⁺ 및 br⁻를 형성합니다.
2. 결정 격자 : 보다 정확한 표현은 결정 격자 다이어그램으로, 반복 패턴으로 이온의 배열을 보여줍니다.
-Liions와 Br⁻ 이온은 입방 배열에서 번갈아 가며.
-이 다이어그램은 결정의 3D 구조와 정전기력으로 이온이 어떻게 유지되는지를 보여줍니다.
3. 공식 : Libr을 대표하는 가장 간단한 방법은 화학적 공식을 사용하는 것입니다 :Libr. 이 공식은 화합물에서 리튬 대 브롬 이온의 비율을 나타낸다 (1 :1).
요약 :
Libr의 간단한 그림을 그릴 수는 없지만 다른 방법을 사용하여 구조와 이온 간의 결합을 나타낼 수 있습니다.
* 루이스 도트 다이어그램 : 전자 전달을 설명합니다.
* 크리스탈 격자 다이어그램 : 이온의 3D 배열을 보여줍니다.
* 화학 공식 : 이온 성 화합물의 가장 간단한 표현.