분자식 :
* 보여준 것 : 분자에 존재하는 원자의 유형 및 양.
* 예 : h₂o (물)
* 제공된 정보 :
* 존재하는 요소 (수소 및 산소)를 알려줍니다.
* 각 원자의 수를 알려줍니다 (2 개의 수소, 산소 1 개)
* 은 표시되지 않습니다 : 분자에서 원자의 배열.
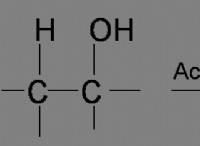
구조 공식 :
* 보여준 것 : 그들 사이의 결합을 포함하여 분자에서 원자의 배열.
* 예 :
* H-O-H (물)
* ch₃-ch₃-ch₂ (프로판)
* 제공된 정보 :
* 분자식의 모든 정보.
* 분자 내 원자의 순서와 연결.
* 종종 채권의 유형 (단일, 이중, 트리플)도 표시됩니다.
* 은 표시되지 않습니다 : 분자의 3D 모양 (매우 간단한 분자 제외).
이런 식으로 생각하십시오 :
* 분자식은 레시피 목록과 같습니다. 어떤 성분이 필요한지 알려주지 만 결합하는 방법은 알려줍니다.
* 구조 공식은 단계별 레시피와 같습니다. 재료의 순서와 결합 방법을 보여줍니다.
사용시기 :
* 분자식 : 분자 조성 (예 :화학 방정식 작성, 어금니 질량 계산)의 간단한 표현이 필요할 때 사용됩니다.
* 구조 공식 : 분자 내에서 원자의 배열을 이해해야 할 때 사용됩니다 (예 :화학적 특성 예측, 이성질체 식별).