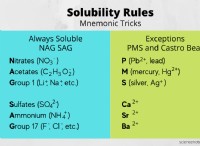
* 포화 솔루션 : 포화 용액은 더 이상 용질 (이 경우 KCl)이 주어진 온도에서 용해 될 수없는 용액입니다. 용해 될 수있는 용질의 양은 온도와 물질의 용해도에 따라 다릅니다.
* 용해도 : KCl의 용해도는 온도에 따라 다릅니다. 예를 들어, 20 ℃에서 약 34.4 그램의 KCl은 100g의 물에 용해 될 수있다. 더 높은 온도에서는 더 많은 KCL이 용해 될 수 있습니다.
* 볼륨 문제 : 포화 용액에서 KCl의 질량은 용액의 부피에 의존한다. 포화 용액 100ml가있는 경우 1 리터의 포화 용액이있는 경우와 다른 덩어리의 KCL을 가질 수 있습니다.
포화 용액에서 KCL의 질량을 계산하려면 다음을 알아야합니다.
1. 온도 : 용액의 온도는 KCl의 용해도를 결정합니다.
2. 볼륨 : 용액의 부피는 용해 된 KCl의 총량을 결정합니다.
예 :
500ml의 부피로 20 ° C의 포화 용액에서 KCl의 질량을 찾으려고한다고 가정 해 봅시다.
1. 용해도 : 20 ℃에서 KCl의 용해도는 34.4 g/100g의 물이다.
2. 볼륨 변환 : 500 ml를 물 그램으로 변환하십시오. 물의 밀도가 1 g/ml라고 가정하면 500 ml의 물 무게는 500g입니다.
3. KCl 질량 계산 : 100g의 물은 34.4 g의 KCl을 용해시킬 수 있기 때문에 500g의 물이 용해 될 수 있습니다 :(500g의 물) * (34.4 g KCl / 100 g 물) =172 g KCl.
따라서, 500 mL의 부피를 갖는 20 ℃에서 KCl의 포화 용액에서, 약 172g의 KCl이있을 것이다. .