알칸 치환 반응에서 가장 흔한 반응물은 할로겐 입니다. , 특히 염소 (Cllor) 및 브로 민 (Bromine), 빛 또는 열 의 존재하에 .
이유는 다음과 같습니다.
* 할로겐은 전자성입니다 : 그들은 전자에 대해 강한 친화력을 가지고 있으며 알칸에서 전자가 풍부한 C-H 결합을 공격 할 수 있습니다.
* 빛 또는 열은 에너지를 제공합니다. 이 에너지는 할로겐-할로겐 결합을 파괴하여 할로겐 라디칼을 생성하는 데 필요합니다. 이러한 라디칼은 반응성이 높으며 치환 반응을 시작할 수 있습니다.
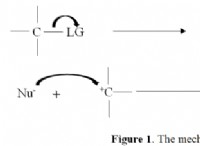
반응 메커니즘은 자유 라디칼 연쇄 반응입니다 :
1. 시작 : 할로겐 분자는 에너지를 흡수하고 2 개의 할로겐 라디칼로 분해합니다.
2. 전파 : 할로겐 라디칼은 알칸 분자와 반응하여 수소 원자를 추상화하고 알킬 라디칼을 형성합니다. 이 알킬 라디칼은 할로겐 분자와 반응하여 할로겐화 된 알칸과 다른 할로겐 라디칼을 형성합니다. 이 과정은 연쇄 반응에서 계속됩니다.
3. 종료 : 두 개의 라디칼은 결합하여 안정적인 분자를 형성하여 연쇄 반응을 종료합니다.
예 :
빛의 존재에서 메탄 (CH주)과 염소 (CL₂)의 반응은 클로로 메탄 (CHATCL) 및 염산 (HCL)을 생성합니다.
```
ch₄ + cl→ → ch₃cl + hcl
```
알칸 치환 반응에서 다른 가능한 반응물 :
* 다른 전기성 : 질산 (HNO₃)과 같은 강산은 알칸과 반응하여 질화라고하는 과정에서 니트로 알칸을 형성 할 수 있습니다.
* 산소 : 알칸은 고온에서 산소와 반응하여 연소 반응에서 이산화탄소와 물을 생성 할 수 있습니다. 그러나 이것은 기술적으로 대체 반응이 아닙니다.
주목하는 것이 중요합니다 :
* 알칸과의 치환 반응은 일반적으로 기능 그룹을 함유하는 다른 유기 화합물과의 반응에 비해 느리게 느리고 효율적입니다.
* 알칸 분자에 다수의 수소 원자가 존재하면 반응 조건에 따라 다양한 생성물이 형성 될 수있다.