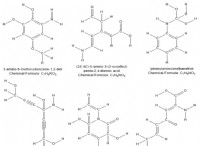
1. 분자 당 원자 수를 결정하십시오 :
* 황산 (H₂SO₄)은 다음과 같습니다.
* 2 수소 원자 (H)
* 1 유황 원자
* 4 산소 원자 (O)
* 분자 당 총 원자 :2 + 1 + 4 =7 원자
2. Avogadro의 번호를 사용하십시오 :
* Avogadro의 수는 1 몰의 모든 물질에는 6.022 x 10²³ 입자 (원자, 분자 등)가 포함되어 있다고 명시하고 있습니다.
3. 총 원자 수를 계산하십시오 :
* 1 단계 : 1.5 몰의 황산에서 총 분자 수를 계산하십시오.
1.5 mol H₄So₂ × (6.022 x 10²³ 분자/몰) =9.033 x 10²³ 분자
* 2 단계 : 분자 수에 분자 당 원자의 수를 곱하십시오.
(9.033 x 10²³ 분자) × (7 원자/분자) =6.323 x 10²⁴ 원자
따라서 따라서 1.5 몰의 황산에 약 6.323 x 10²ATOM이 존재합니다.