다음은 다음과 같습니다.
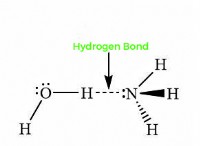
* 용해 : Nahco₃는 물에 용해되어 이온으로 분리됩니다 :Na⁺ (나트륨 이온) 및 HCO₃⁻ (수소 탄산염 이온).
* 가수 분해 : 수소 탄산염 이온 (HCO₃⁻)은 물 분자 (HATER)와 반응하여 소량의 탄산 (HATCO) 및 수산화 이온 (OHA)을 형성합니다.
```
hco⇌ + h₂o ⇌ h₂o₃ + oh +
```
* pH 변화 : 수산화물 이온 (OH⁻)의 형성은 용액을 약간 기본적으로 만듭니다. 수산화물 이온이 알칼리도의 척도이기 때문입니다.
전반적인 반응 :
전체 반응은 다음과 같이 표현 될 수 있습니다.
```
nahco₃ (s) + h₂o (l) ⇌ na⁺ (aq) + hco₃⁻ (aq) ⇌ na⁺ (aq) + oh⁻ (aq) + h₂co₃ (aq)
```
참고 :
* 솔루션은 약간 기본이지만 강하게 기본적이지는 않습니다. pH는 약 8-9입니다.
* 탄산산 (HATCO)은 불안정하고 이산화탄소 (COS) 및 물 (HATE)으로 빠르게 분해됩니다. 그렇기 때문에 베이킹 소다가 물에 녹을 때 거품이 형성되는 것을 볼 수 있습니다.
* 가수 분해 정도는 Nahco₃의 농도에 따라 다릅니다. 농도가 높을수록 더 기본적인 솔루션이 생길 것입니다.
다른 질문이 있으면 알려주세요.




![[놀라운 비디오] 칠레 하늘은 하늘에 의해 빛을 발합니다](/article/uploadfiles/202211/2022111014493321_S.jpg)
