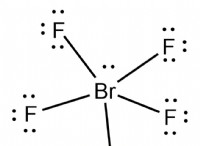
이유는 다음과 같습니다.
* 완전한 연소 : 이 비율은 모든 수소와 산소가 완전히 반응하여 제품으로 물만 생산합니다.
* 최대 에너지 방출 : 이 비율로 연소하면 방출 된 에너지가 극대화되어 가장 뜨거운 불꽃이 생깁니다.
* 효율성 : 이 비율로부터의 편차는 불완전한 연소를 초래하며, 수소 또는 산소가 반응하지 않아 에너지 출력을 감소시키고 일산화탄소와 같은 유해한 부산물을 생성 할 수 있습니다.
예 :
수소의 완전한 연소를위한 화학 방정식은 다음과 같습니다.
2H→ + o → 2H₂O
이 방정식은 2 개의 수소 분자 (H₂)가 하나의 산소 분자 (O₂)와 반응하여 두 분자의 물 (HATE)을 생성 함을 보여준다.
참고 :
2 :1은 최적의 비율이지만, 다양한 비율로 연소가 여전히 발생할 수 있음을 주목하는 것이 중요합니다. 그러나 화학량 론적 비율과의 편차는 반응의 효율과 완전성에 영향을 미쳐 잠재적으로 바람직한 결과를 초래할 수 있습니다.