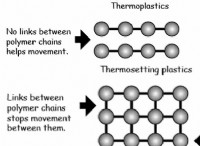
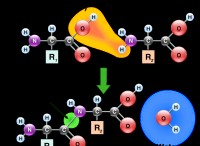
* 산화 : 전자를 잃는 과정.
* 감소 : 전자를 얻는 과정.
* 감소제 : 다른 물질을 감소시키는 물질.
작동 방식 :
* 환원제는 전자를 다른 물질에 기증하여 해당 물질이 전자를 얻도록합니다 (감소).
* 그 과정에서 환원제는 전자를 잃어 버려서 산화됩니다.
이런 식으로 생각하십시오 :
* 환원제는 전자를 제공하여 다른 물질을 "감소"합니다.
* 환원제 자체는 전자를 잃어 "산화"를받습니다.
예 :
아연 (Zn)과 구리 이온 (Cu²⁺) 사이의 반응에서 아연은 환원제로서 작용한다.
Zn (s) + cu²⁺ (aq) → zn²⁺ (aq) + cu (s)
* 아연 (Zn)은 2 개의 전자를 잃고 Zn²으로 산화됩니다.
* 구리 이온 (Cu²⁺)은 2 개의 전자를 얻고 구리 금속 (Cu)으로 감소됩니다.
키 테이크 아웃 : 환원제는 산화 환원 반응에서 항상 산화되고 (전자를 잃음).