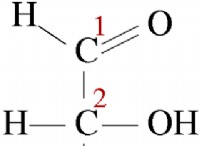
* na+ (나트륨 이온)
* 오- (수산화물 이온)
수산화 이온 (OH-) 용액을 기본적으로 만들고 수산화 이온의 농도가 높을수록, 용액 더 기본적인 (알칼리성) .
따라서, 수산화 나트륨 용액의 pH는 그 농도에 달려있다. .
* 수산화 나트륨의 매우 희석 된 용액은 7에 가까운 pH를 가질 것입니다 (중성)
* 수산화 나트륨의 농도가 증가함에 따라 pH도 증가하여 더욱 기본화됩니다.
수산화 나트륨 용액의 pH를 계산하려면 그 농도를 알아야합니다. 그런 다음 다음 공식을 사용할 수 있습니다.
pH =14 -POH
여기서 poh =-log [oh -]
[oh-]는 리터당 두더지의 수산화물 이온의 농도입니다 (m).
예 :
NAOH의 농도가 0.1m 인 경우, POH는 다음과 같습니다.
* poh =-log (0.1) =1
* pH =14-1 =13
따라서, 수산화 나트륨의 0.1m 용액은 pH 13을 가질 것이다.