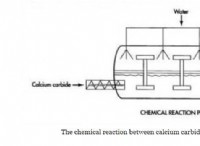
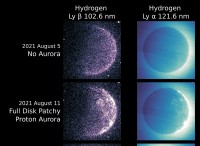
* 이온 결합 : 이온 결합은 하나의 원자 (일반적으로 금속)가 긍정적으로 하전 된 양이온이되기 위해 전자를 잃는 반면, 다른 원자 (일반적으로 비금속)는 전자를 얻기 위해 전자를 얻을 때 형성됩니다. 이 반대로 하전 된 이온은 정전기력을 통해 서로를 끌어들입니다.
* electrovalency : 나트륨 (NA)은 하나의 원자가 전자를 갖고, 염소 (CL)는 7 개의 원자가 전자를 갖는다. 나트륨은 안정적인 옥트 구성을 달성하기 위해 하나의 원자가 전자를 잃는 경향이 있으며, +1 양이온 (Na +)을 형성합니다. 반면에 염소는 하나의 전자를 얻기 위해 하나의 전자를 얻어 -1 음이온 (Cl-)을 형성합니다.
* 화학량 측정법 : 전기 중립성을 달성하기 위해서는 양전하의 수는 음전하의 수와 같아야합니다. 따라서, 하나의 나트륨 이온 (Na+)은 하나의 염화물 이온 (Cl-)과 결합하여 중성 화합물을 형성해야한다.
염화나트륨의 올바른 공식은 Na2Cl이 아닌 NaCl입니다.
요약 :
* NA2CL은 2 개의 나트륨 원자가 하나의 염소 원자와 결합하여 이온 결합 및 전기 유도의 원리를 위반한다는 것을 의미한다.
* 올바른 공식 인 NaCl은 나트륨 및 염소 이온의 1 :1 비율을 반영하여 전기 중립성과 안정적인 이온 성 화합물을 보장합니다.