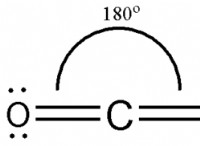
솔루션 이해
* 아세트산 (ch₃cooh) : 부분적으로 물에서 이온화되는 약산.
* 나트륨 아세테이트 (ch₃coona) : 아세트산의 소금. 그것은 물에 완전히 분리되어 아세트산의 컨쥬 게이트 염기 인 아세테이트 이온 (ch₃cool)을 제공합니다.
버퍼 시스템
이 용액은 약산 (아세트산) 및 그의 컨쥬 게이트 염기 (아세테이트 이온)를 함유하기 때문에 완충 시스템을 형성한다. 버퍼는 pH의 변화에 저항합니다.
Henderson-Hasselbalch 방정식
버퍼 솔루션의 pH를 계산하기 위해 Henderson-Hasselbalch 방정식을 사용합니다.
pH =pka + log ([컨쥬 게이트베이스]/[약산])
계산
1. 아세트산의 PKA : 아세트산의 PKA는 대략 4.75입니다.
2. 농도 : 아세트산과 나트륨 아세테이트의 농도는 동일하기 때문에 방정식을 단순화 할 수 있습니다.
[접합체베이스]/[약산] =1
3. 방정식에 연결하십시오 :
pH =4.75 + 로그 (1)
pH =4.75 + 0
pH =4.75
결론
동일한 농도의 아세트산 및 나트륨 아세테이트를 함유하는 0.20 mol/L 용액의 pH는 대략 4.75 이다. .