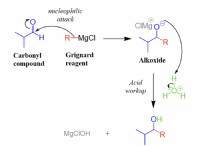
* 강한 트리플 본드 : 질소 원자는 매우 강한 트리플 결합에 의해 함께 유지되며, 이는 많은 에너지가 파손되어야합니다. 이것은 질소를 매우 안정적이고 반응하지 않습니다.
* 높은 활성화 에너지 : 질소 산화물을 형성하기 위해 (NO 및 NO 2 ), 트리플 본드가 깨져야합니다. 이를 위해서는 활성화 에너지로 알려진 상당한 에너지 입력이 필요합니다.
* 동역학적 불활성 : 높은 활성화 에너지는 정상 온도와 압력에서 반응을 매우 느리게 만듭니다.
* 전자 구성 : 질소 원자는 안정적인 전자 구성을 가지므로 다른 원자와 전자를 공유하는 것을 꺼려합니다.
여기에 이것이 실제 시나리오에서 어떻게 진행되는지 입니다
* 공기 구성 : 질소는 우리가 호흡하는 공기의 약 78%를 구성합니다. 산소도 존재하더라도 질소의 안정성은 정상적인 대기 조건에서 쉽게 반응하지 않는다는 것을 의미합니다.
* 산업 공정 : 질소가 산소와 반응하기 위해서는 고온, 고압 또는 촉매를 사용해야합니다. 이것은 질산 및 암모니아 생산과 같은 산업 공정이 달성되는 방식입니다.
이렇게 생각하십시오 : 친구 그룹이 모두 서로를 매우 단단히 붙잡고 놓아 내기를 거부한다고 상상해보십시오. 이것은 질소의 강한 트리플 결합과 유사합니다. 그것들을 분리하려면 많은 노력이 필요하지만 일단 분리되면 산소와 같은 산소와 같은 새로운 연결을 형성 할 수 있습니다.