* 전기 음성 차이 : 황과 질소는 상당한 전기 음성 차이를 갖는다. 질소는 황 (2.58)보다 전기 음성 (3.04)입니다. 이것은 질소가 공유 전자를 더 강하게 당기는 것을 의미합니다.
* 안정성 : 그들 사이의 단일 공유 결합은 매우 불안정 할 것입니다. 전자는 질소로 더 많이 당겨서 매우 극성 결합을 만듭니다. 이 극성은 분자를 불안정하게 만들 것입니다.
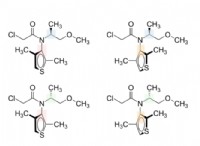
대신, 당신은 다음과 같은 황과 질소와 관련된보다 복잡한 구조를 형성 할 수 있습니다.
* 설파 마이드 : 이들은 설폰 아미드 기능 그룹 (SO₂nh₂)을 함유하는 화합물이다. 여기서 황은 산소 다리를 통해 질소에 결합됩니다.
* 설포이 미드 : 이들 화합물은 설 포이 니 미드 기 (SOJ-)를 함유한다. 설파 마이드와 유사하게, 황은 산소 교량을 통해 질소에 결합됩니다.
* 황화물 및 설폭 사이드 : 이들은 탄소 사슬 또는 고리를 통해 질소에 결합 된 황을 포함한다.
예 : 분자 설파 닐라 미드 (중요한 항생제)에서, 설 폰 아미드 그룹의 산소 원자를 통해 황이 질소에 결합된다.
요약하자면, 황과 질소 사이의 간단한 단일 공유 결합을 직접 형성하는 것은 전기 음성 성 차이로 인해 유리하지 않습니다. 그러나 다른 원자와 관련된보다 복잡한 구조에 연결될 수 있습니다.