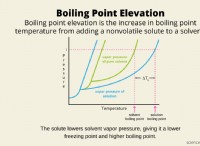
VSEPR 모델에 기초한 CCL4 및 NH3의 극성에 대한 가설 :
ccl4 :
* VSEPR 모델 : CCL4의 중심 탄소 원자는 사면체 배열에서 4 개의 염소 원자로 둘러싸여있다 (AX4).
* 극성 가설 : 사면체 형상과 탄소 및 염소의 유사한 전기 음성성으로 인해 개별 C-Cl 결합 쌍극자가 서로를 취소합니다. 이것은 비극성 분자를 초래한다 .
nh3 :
* VSEPR 모델 : NH3의 중심 질소 원자는 삼각 피라미드 배열 (AX3E)에서 3 개의 수소 원자와 1 개의 고독한 전자 쌍으로 둘러싸여있다.
* 극성 가설 : N-H 결합은 질소의 전기성이 높기 때문에 극성입니다. 질소의 고독한 쌍은 분자의 전체 비대칭에 기여합니다. 이러한 요인은 극성 분자를 초래한다 질소 원자를 향한 순 쌍극자 모멘트.
요약 :
* ccl4 nonpolar 인 것으로 예상됩니다 대칭 사면체 기하학과 결합 쌍극자의 취소로 인해.
* nh3 Polar 인 것으로 예상됩니다 비대칭 삼각 피라미드 형상 및 질소에 고독한 쌍의 존재로 인해 순 쌍극자 모멘트가 생성되기 때문입니다.
참고 : 이것은 VSEPR 모델을 기반으로하는 가설입니다. 극성을 확인하려면 실험적 증거가 필요합니다.