1. 부분 이온화 :
* 약산은 용액에서 부분적으로 이온화됩니다. 이것은 그들이 성분 이온 (H+와 음이온)으로 완전히 분리되지 않는다는 것을 의미합니다.
대조적으로, 강산은 거의 완전히 이온화됩니다.
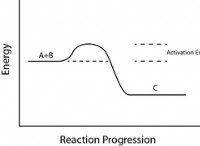
2. 평형 :
* 약산은 산과 그의 접합체베이스가 존재하는 용액의 평형 상태에 존재한다. 이것은 다음 방정식으로 표시 될 수 있습니다.
* ha (aq) a h + (aq) + a- (aq)
* ha =약산
* A- =컨쥬 게이트베이스
3. 낮은 산 해리 상수 (KA) :
* KA 값은 산의 강도를 측정 한 것입니다.
* 약산은 작은 KA 값을 가지며 일반적으로 1 미만입니다. 이것은 양성자 (H+)를 매우 쉽게 기증하지 않는다는 것을 의미합니다.
4. 1보다 큰 pH :
* 약산은 용액에서 1보다 큰 pH (종종 2 또는 3보다 큰)를 갖는다.
5. 덜 반응 :
* 강산과 비교하여 약산은 염기와 더 천천히 반응합니다.
6. 예 :
* 아세트산 (ch3cooh)
* 탄산 산 (H2CO3)
* 포름산 (HCOOH)
* 젖산 (CH3CH (OH) COOH)
* 구연산 (C6H8O7)
여기에 유용한 비유가 있습니다 :
수줍은 사람으로서 약한 산을 상상해보십시오. 그들은 한 번에 약간의 (H+ 이온) 만 제공하며, 대부분 원래 형태로 유지하는 것을 선호합니다. 반면에 강한 산은 나가는 사람들과 같으며, 모든 "자아"(H+ 이온)를 쉽게 포기하여 새로운 무언가의 일부가됩니다.