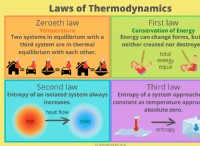
전자 친화력 경향 및 예외
전자 친화력 (EA)은 전자가 기체 상태의 중성 원자에 첨가되어 음성 이온을 형성 할 때 에너지의 변화이다. 다음은 트렌드와 예외의 분석입니다.
일반 트렌드 :
1. 기간에 걸쳐 : EA는 일반적으로 증가합니다 기간에 걸쳐 왼쪽에서 오른쪽으로. 우리가 기간에 걸쳐 이동함에 따라 핵 내 양성자 수가 증가함에 따라 효과적인 핵 전하가 증가하기 때문입니다. 이 강력한 매력은 들어오는 전자를보다 강력하게 끌어 당겨 더욱 부정적인 EA 값 (더 많은 에너지 방출)을 초래합니다.
2. 그룹 다운 : EA는 일반적으로 감소 그룹 아래. 원자 크기가 그룹 아래로 증가함에 따라 첨가 된 전자가 핵에서 멀리 떨어져 있기 때문입니다. 약한 매력은 덜 부정적인 EA 값 (에너지 방출이 적음)을 초래합니다.
예외 :
이러한 예외는 전자 구성, 차폐 효과 및 결과 음이온의 안정성과 같은 요인으로 인해 발생합니다.
1. 그룹 1 (알칼리 금속) : ea는 낮고 약간 양수 입니다 첨가 된 전자가 새로운 더 높은 에너지 수준으로 들어가기 때문에 알칼리 금속의 경우, 이전의 것보다 안정적이지 않습니다.
2. 그룹 17 (Halogens) : ea는 매우 부정적인 입니다 할로겐의 경우 안정적인 고귀한 가스 구성을 달성하기 위해 전자를 쉽게 수용하기 때문입니다. 그러나 불소는 염소보다 약간 낮은 EA를 가지고 있습니다. 이는 작은 크기의 불소로 인한 것이며, 이는 기존 전자와 들어오는 전자 사이의 전자 반발을 초래합니다.
3. 그룹 18 (귀족 가스) : ea는 양성 입니다 고귀한 가스의 경우 안정적인 전자 구성이 있고 전자를 추가하면 이러한 안정성을 방해합니다.
4. 그룹 14 (카본 그룹) : ea는 음성 입니다 탄소 및 실리콘이지만 양성 게르마늄, 주석 및 리드의 경우. 더 무거운 원소에 첨가 된 전자가 더 높은 에너지 수준으로 들어가서 음이온을 덜 안정적으로 만들기 때문입니다.
5. 그룹 15 (질소 그룹) : ea는 음성 입니다 질소의 경우 양성 인을 위해. 이는 질소가 반으로 채워진 p 궤도를 가지고 있기 때문에 더 안정적인 반면 인은 덜 안정적인 전자 구성을 가지고 있기 때문입니다.
기타 요인 :
* 전자 구성 : 반으로 채워 지거나 완전히 채워진 서브 쉘이있는 원자는 EA가 낮은 경향이 있습니다.
* 차폐 : 내부 전자의 차폐 효과는 효과적인 핵 전하를 감소시켜 EA를 낮출 수 있습니다.
* 음이온 안정성 : 생성 음이온의 안정성은 EA에 영향을 줄 수 있습니다. 안정적인 전자 구성을 갖는 음이온은 더 높은 EA를 갖는 경향이 있습니다.
요약하면, EA 트렌드는 주기율표를 가로 질러 나 아래로 관찰 될 수 있지만 전자 구성, 차폐 및 음이온 안정성과 같은 요인의 복잡한 상호 작용으로 인해 몇 가지 예외가 발생합니다. .