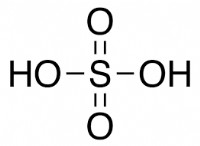
1. 루이스 구조를 그리십시오 :
* 황 (s) : 6 개의 원자가 전자가 있습니다.
* 산소 (O) : 6 개의 원자가 전자가 있습니다.
* 수소 (H) : 원자가 전자가 1 개 있습니다.
루이스 구조는 다음과 같습니다.
```
영형
// \\
O-S-O
\\ //
영형
|
시간
|
시간
```
2. 단일, 이중 및 트리플 본드를 식별하십시오 :
* 단일 채권 : 각 단일 결합 (O-S, O-H)에는 One Sigma Bond 가 포함됩니다 .
* 이중 채권 : 각 이중 결합 (S =O)에는 1 개의 시그마 본드와 하나의 PI 본드 가 포함됩니다. .
3. 채권 계산 :
* 시그마 본스 : 2 (S-O) + 2 (S-O) + 2 (O-H) = 6 시그마 본스
* Pi Bonds : 2 (s =o) = 2 Pi Bonds
따라서 따라서 H ,So₄는 6 개의 Sigma Bonds와 2 개의 PI 결합을 가지고 있습니다.