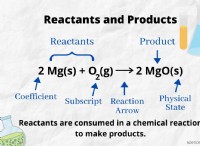
전기 화학 시리즈 이해
* 표준 감소 전위 (E °) : 주어진 값 (Ag+의 경우 0.80V 및 Cu2+의 경우 0.34V)은 표준 감소 전위를 나타냅니다. 감소 전위가 높을수록 종이 전자를 얻고 감소하는 경향이 더 높음을 나타냅니다.
* 자발적 반응 : 갈바닉 세포 (전기를 생산하는 세포)에서, 전체 세포 전위 (E ° 세포)가 양성인 경우 반응은 자발적으로 진행될 것이다. 이것은 더 강한 산화제 (더 높은 E °) 감소 및 약한 산화제 (하부 E °)를 산화함으로써 달성된다.
반 반응 결정
1. 더 강한 산화제를 식별하십시오 : 은 이온 (Ag+)은 구리 이온 (CU2+) (0.34V)보다 더 높은 환원 전위 (0.80V)를 갖는다. 이것은 Ag+가 전자를 얻는 경향이 더 강해지고 감소하는 것을 의미합니다.
2. 감소 반 반응 : 더 높은 감소 전위와의 반 반응은 감소로 발생할 것입니다.
ag + (aq) + e- → Ag (s) (E ° =0.80 V)
3. 산화 반 반응 : 낮은 감소 전위와의 반 반응은 산화로서 발생할 것이다 (감소 과정의 역) :
cu (s) → Cu2 + (aq) + 2e- (E ° =-0.34 V)
전체 세포 반응
반 반응을 결합하려면 다음을 수행해야합니다.
* 균형 전자 : 전자의 균형을 맞추기 위해 반 반응을 2로 곱하십시오.
2 Ag + (aq) + 2e- → 2 ag (s)
* 반 반응을 추가하십시오 : 전체 세포 반응을 얻으려면 균형 잡힌 반 반응을 추가하십시오.
2 Ag + (AQ) + Cu (S) → 2 Ag (S) + Cu2 + (AQ)
세포 전위 (E ° 세포)
* 세포 전위 계산 :E ° 세포 =E ° 환원 (음극) -E ° 산화 (양극)
E ° 셀 =0.80 V- (-0.34 V) =1.14 V
요약 :
* 양극 (산화) : Cu (S) → Cu2 + (AQ) + 2E-
* 음극 (환원) : 2 Ag + (AQ) + 2E- → 2 Ag (S)
* 전체 세포 반응 : 2 Ag + (AQ) + Cu (S) → 2 Ag (S) + Cu2 + (AQ)
* e ° 셀 =1.14 V
이 반응은 세포 전위가 양수이기 때문에 자발적입니다.