이온 성 화합물
* 형성 : 양으로 하전 된 이온 (양이온)과 음의 하전 된 이온 (음이온) 사이의 정전기 인력에 의해 형성된다.
* 본딩 : 한 원자에서 다른 원자로 전자를 전달하는 이온 결합.
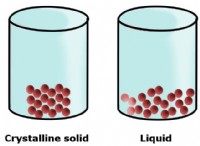
* 구조 : 일반적으로 실온에서 결정질 고체로 존재합니다. 이온은 규칙적이고 반복되는 패턴으로 배열됩니다.
* 용해도 : 일반적으로 물과 같은 극성 용매에 용해됩니다.
* 전도도 : 이온의 자유로운 움직임으로 인해 물에 용해되거나 녹을 때 전기의 우수한 도체.
* 용융/비등점 : 일반적으로 이온들 사이의 강한 정전기력으로 인해 녹는 점과 끓는점이 높습니다.
* 예 : 염화나트륨 (NaCl), 산화 칼슘 (CAO), 칼륨 브로마이드 (KBR)
비 이온 화합물
* 형성 : 원자 사이의 전자 공유에 의해 형성된다.
* 본딩 : 전자가 공유되는 공유 결합.
* 구조 : 실온에서 고체, 액체 또는 가스로 존재할 수 있습니다. 그들의 구조는 이온 성 화합물보다 더 다양합니다.
* 용해도 : 용해도는 특정 화합물과 용매에 따라 다릅니다. 일부는 극성 용매, 일부는 비극성 용매에 용해됩니다.
* 전도도 : 흑연과 같은 몇 가지 특수한 경우를 제외하고 일반적으로 전기 도체가 열악합니다.
* 용융/비등점 : 용융점 및 비등점은 공유 결합의 강도에 따라 크게 다릅니다.
* 예 : 물 (HATE), 이산화탄소 (CO₂), 메탄 (ch₄)
테이블의 주요 차이
| 기능 | 이온 성 화합물 | 비이 온성 화합물 |
| --- | --- | --- |
| 본딩 | 이온 결합 (전자 전달) | 공유 채권 (전자 공유) |
| 구조 | 결정질 고체 | 다양한 상태 (고체, 액체, 가스) |
| 용해도 | 일반적으로 물에 용해 | 용해도 변동 |
| 전도도 | 용액 또는 용융 상태의 좋은 도체 | 불쌍한 지휘자 |
| 용융/끓는 지점 | 높은 | 변수 |
이온 또는 비 이온 화합물의 특정 측면에 대해 더 깊이 다이빙을 원하시면 알려주세요!