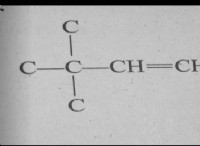
이해 HNO3
* HNO3은 강산 인 질산입니다. 이것은 물에서 완전히 이온화 (해리)를 의미합니다.
* 이온화 반응은 다음과 같습니다. HNO3 (AQ) → H + (AQ) + NO3- (AQ)
계산 pH
1. H+의 몰토리성 : HNO3은 강산이기 때문에, H+ 이온의 농도는 HNO3 용액의 농도와 동일하다. 따라서 [H+] =1.45 M.
2. pH 공식 : pH =-log [H+]
3. 대체 및 계산 : pH =-log (1.45) ≈ -0.16
중요한 참고 : pH 척도는 일반적으로 0에서 14 사이이며 0 미만의 pH 값은 가능하지만 매우 높은 농도의 수소 이온을 나타냅니다.
따라서 1.45 M HNO3 용액의 pH는 약 -0.16입니다.