1. 금속 수산화물 :
* 일반 공식 : m (OH)
* 예 :
* 수산화 나트륨 (NAOH)
* 수산화 칼륨 (KOH)
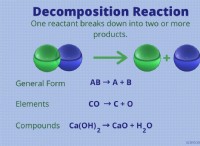
* 수산화 칼슘 (Ca (OH) <서브> 2 ))
* 수산화 마그네슘 (Mg (OH)
2. 일부 금속 산화물 :
* 일반 공식 : m x o y (여기서 m은 금속이고 x와 y는 첨자를 나타냅니다)
* 예 :
* 산수 나트륨 (NA <서브> 2 영형)
* 산화 칼슘 (CAO) - 일반적으로 "라임"이라고합니다.
3. 그룹 1 및 2 금속 염 :
* 일반 공식 : m x (a)
* 예 :
* 탄산나트륨 (NA <서브> 2 Co 3 ))
* 인산 칼륨 (k <서브> 3 po 4 ))
* 클로라이드 칼슘 (CACL 2 ))
4. 암모니아 (nh 3 ) :
* 암모니아는 약한 기초이지만 물에 용해 될 때 기본 솔루션을 생성합니다.
주요 개념 :
* 산과 염기 : 산은 수소 이온을 생성합니다 (H
+
) 용액에서, 염기는 수산화물 이온을 생성한다 (OH
-
) 솔루션에서.
* pH 스케일 : 7의 pH는 중성이고, 7 미만의 값은 산성이고, 7 이상의 값은 기본 (알칼리성)입니다.
* 강한 대 약한베이스 : 강한 염기는 용액에서 이온으로 완전히 분리되는 반면, 약한 염기는 부분적으로 분리됩니다.
그들이 일하는 방법 :
위에 나열된 화합물이 물에 용해되면 물 분자와 반응하여 수산화물 이온을 형성합니다 (OH
-
), 용액의 pH를 증가시켜 기본적으로 만듭니다.
중요한 참고 : 염기의 강도는 화합물과 수산화물 이온을 방출하는 능력에 의존한다. 예를 들어, 수산화 나트륨 (NAOH)은 강한 염기이며 암모니아 (NH <서브> 3 )는 약한 기초입니다.