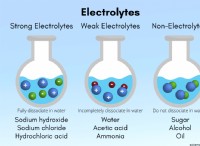
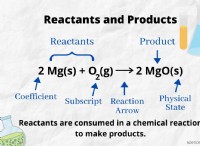
Brønsted-Lowry 이론 :
산과 염기의 가장 널리 받아 들여지는 정의는 Brønsted-Lowry 이론입니다. 이 이론은 다음과 같습니다.
* 산 : 양성자 (H+)를 기증하는 물질
* 베이스 : 양성자를 받아들이는 물질 (H+)
양성자가 중요한 이유 :
* 수소 구조 : 수소 원자는 하나의 양성자와 하나의 전자를 갖는다. 수소 원자가 전자를 잃으면 양성자 (H+)가됩니다.
* 산도 및 pH : 용액에서 양성자 (H+)의 농도는 그 산도를 결정합니다. pH가 낮을수록 양성자의 농도가 높을수록 용액이 더 산성입니다.
산이 양성자를 기증하는 방법 :
* 물에서 : 산은 물과 반응하여 양성자를 방출합니다. 예를 들어, 물 중의 염산 (HCL)은 다음과 같이 반응합니다.
```
HCl + H⇌O ₂ h₃o + + cl-
```
HCL은 양성자 (H+)를 물 분자에 기증하여 하이드로 늄 이온 (HATO+)을 형성한다. 이것이 산성 용액이 고농도의 H+ 이온을 갖는 이유입니다.
기타 주요 요점 :
* 모든 산이 강한 것은 아닙니다. 일부 산은 강하기 때문에 양성자를 쉽게 기증합니다. 다른 산은 약해서 양성자를 쉽게 기증한다는 것을 의미합니다.
* 공액 산-염기 쌍 : 산이 양성자를 기증 할 때, 그것은 컨쥬 게이트 염기를 형성한다. 예를 들어, HCl 반응에서, HCl의 컨쥬 게이트 염기는 Cl-이다.
요약 :
산의 양성자 공여자 정의는 Brønsted-lowry 이론과 산도를 결정하는 데 양성자의 역할에서 비롯됩니다. 산은 반응에서 양성자를 기증하여 용액에서 H+ 이온의 농도를 증가시키고 용액을보다 산성으로 만듭니다.