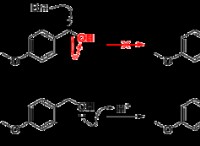
여기에는 약산을 정의하는 것이 다음과 같습니다.
* 용액에서의 부분 이온화 : 약산이 물에 용해되면 부분적으로 이온화되므로 모든 양성자 (H+)를 용액에 기증하지 않습니다.
* 평형 : 약산의 이온화는 평형 반응이며, 이는 양방향으로 갈 수 있음을 의미합니다.
* 전방 반응 : HA (약산) + H 2 o 3 h 3 o + (Hydronium 이온) + a - (공액 기초)
* 역 반응 : H 3 o + + a - ha + h 2 영형
* 낮은 ka 값 : 약산은 산산화 상수 (ka) 값이 낮으며, 이는 이들이 작은 정도만 이온화 함을 나타낸다.
약산의 예 :
* 카르 복실 산 : 아세트산 (ch 3 COOH), 포름산 (HCOOH), 젖산 (CH <서브> 3 CH (OH) COOH)
* 무기산 : 탄산산 (H 2 Co 3 ), 붕산 (h 3 bo 3 ))
* 유기산 : 구연산 (c 6 H 8 o 7 ), 옥살산 (h 2 c 2 o 4 ))
키 테이크 아웃 :
특정 공식 대신, "약산"을 산이 용액에서 어떻게 행동하는지 설명하는 특성으로 생각하십시오.