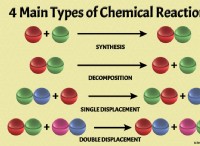
철 수산화 철 이해
* 용해도 : 수산화 강은 물에 매우 불용성이 있습니다. 이는 쉽게 용해되지 않으며 용액에 상당한 양의 수산화 이온 (OH-)을 방출하지 않음을 의미합니다.
* 평형 : 불용성이지만 소량의 Fe (OH) ₂가 용해되어 평형을 설정합니다.
Fe (OH) ₂ (S) ⇌ Fe²⁺ (aq) + 2oh⁻ (aq)
* 수산화 이온 : 방출 된 수산화 이온은 용액의 기본 특성에 기여합니다.
pH 결정
1. 용해도 제품 (KSP) : pH를 결정하려면 Fe (OH) ₂에 대한 용해도 제품 상수 (KSP)를 알아야합니다. KSP 값은 화합물의 용해에 대한 평형 상수를 나타낸다. 화학 교과서 나 온라인 데이터베이스 에서이 값을 찾을 수 있습니다.
2. 평형 계산 : KSP 값을 사용하여 용액에서 수산화 이온 ([OHAT])의 농도를 계산합니다.
3. pH 계산 : [OH [] 농도가 있으면 다음을 사용하여 POH를 계산할 수 있습니다.
poh =-log [OH태]
4. poh의 pH : 마지막으로 관계를 사용하여 pH를 계산할 수 있습니다.
pH + poh =14
예
Fe (OH) ₂에 대한 KSP가 4.87 x 10 ¹⁷이라고 가정 해 봅시다.
1. 평형 : Fe (OH) ₂ (S) ⇌ Fe²⁺ (aq) + 2oh⁻ (aq)
2. ksp 표현 : ksp =[fe² fe] [OH태] ²
3. Fe (OH) ₂ :의 어금니 용해도가되도록하십시오 그런 다음 [fe² =] =s 및 [OH⁻] =2s입니다
4. KSP 표현으로 대체 : 4.87 x 10⁻¹ x =(S) (2s) ²
5. "S"를 해결 : S =1.06 x 10 ℃
6. [OH태] =2S =2.12 x 10 ℃
7. poh : poh =-log (2.12 x 10⁻⁶) =5.67
8. pH : pH =14-5.67 = 8.33
중요한 메모 :
* 세포 수산화물의 포화 용액의 pH는 약간 염기성이 될 것이다 (pH는 7보다 큰 pH).
*이 계산은 용액이 25 ° C라고 가정합니다. pH는 온도에 따라 다를 수 있습니다.
* 세기 수산화물을 함유하는 용액의 실제 pH는 특정 조건 (온도, 다른 이온의 존재 등)에 따라 다릅니다.
정확한 pH 값이 필요한 경우 화학 전문가에게 문의하거나 pH 미터를 사용하십시오.