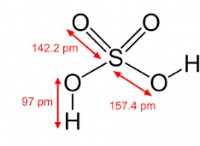
이온화 에너지 (IE) :
* 정의 : 즉,지면 상태의 중성 기체 원자에서 전자를 제거하는 데 필요한 최소 에너지입니다.
* 이온 결합과의 관계 : 낮은 이온화 에너지를 갖는 요소 전자를 잃고 양이온 (양이온)을 형성 할 가능성이 높습니다. 전자를 제거하는 데 에너지가 적어 프로세스를 유리하게 만들기 때문입니다.
* 예 : 금속은 일반적으로 이온화 에너지가 낮으므로 이온 결합에서 양이온 형성기가 양호합니다.
전자 친화력 (EA) :
* 정의 : EA는 전자가 접지 상태의 중성 기체 원자에 첨가 될 때 에너지의 변화입니다.
* 이온 결합과의 관계 : 높은 전자 친화도를 갖는 요소 전자를 얻고 음이온 (음이온)을 형성 할 가능성이 높습니다. 전자를 추가하면 에너지를 방출하여 프로세스가 유리하게 만들어지기 때문입니다.
* 예 : 비금속은 일반적으로 높은 전자 친화도를 가지므로 이온 결합에서 좋은 음이온 형성제가됩니다.
결합 효과 :
* 이온화 에너지가 낮은 원자 (전자를 잃는 경향)가 높은 전자 친화력 (전자를 얻는 경향)과 원자와 상호 작용하면 이온 결합이 형성 될 수 있습니다.
* 전자의 전달은 반대로 하전 된 이온 (양이온 및 음이온)의 형성으로 이어진 다음 서로 정전기 적으로 끌어 이온 결합을 형성합니다.
요약 :
* 낮은 IE + High EA : 이온 결합을 형성하는 강한 경향.
* 높음 IE + LOW EA : 이온 결합을 형성하는 약한 경향.
예 :
* 나트륨 (NA) 및 염소 (CL) : 나트륨은 IE가 낮으므로 전자를 잃고 NAI를 형성하기가 쉽습니다. 염소는 EA가 높은 EA를 가지고있어 전자를 얻고 Cl⁻를 형성하기를 간절히 원합니다. Na between와 Cl⁻ 사이의 강한 인력은 이온 성 화합물 NaCl (표 염)의 형성을 초래한다.
* 마그네슘 (mg) 및 산소 (O) : 마그네슘은 상대적으로 낮은 반면 산소는 EA가 매우 높습니다. 이는 Mg²⁺ 및 O²⁻ 이온의 형성을 초래하여 이온 성 화합물 MgO를 형성한다.
IE, EA 및 이온 결합 형성 사이의 관계를 이해함으로써, 우리는 상이한 요소들 사이의 이온 결합 가능성을 예측할 수있다.