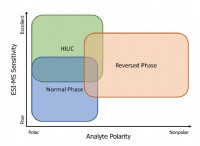
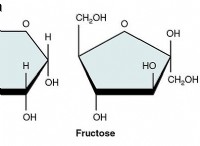
일반 원칙 :
* ""처럼 녹는 것처럼 :비슷한 극성을 가진 물질은 서로 녹을 가능성이 더 높습니다.
* 극성 물질 (물과 같은)는 다른 극성 물질 (설탕, 소금, 알코올)에 잘 녹입니다.
* 비극성 물질 (오일과 같은)는 다른 비극성 물질 (그리스와 같은)에 잘 녹입니다.
물에 용해되는 물질의 유형 :
* 이온 성 화합물 : 이들은 긍정적이고 음전 하전 된 이온 사이의 정전기 인력에 의해 형성된다. 예 :
* 소금 :NaCl (테이블 소금), KCl (염화 칼륨)
* 베이스 :NaOH (수산화 나트륨), KOH (수산화 칼륨)
* 극성 공유 화합물 : 이들은 전자를 불평등하게 공유하여 분자에 부분 양성 및 부분 음전하를 만듭니다. 예 :
* 설탕 :포도당, 자당
* 알코올 :에탄올, 메탄올
* 산 :HCL (염산), HNO3 (질산)
* 가스 : 양은 온도와 압력에 의존하지만 일부 가스는 물에 용해 될 수 있습니다. 예 :
* 산소 :수생 생활에 필수적입니다
* 이산화탄소 :바다 산성화에 기여하는 물에서 카본 산 형성
물에 잘 녹지 않는 물질 :
* 비극성 화합물 : 이들은 전자 공유도 가지고있어 중대한 요금이 부과되지 않습니다. 예 :
* 오일 :식물성 기름, 올리브 오일
* 지방 :버터, 라드
* 왁스 :밀랍, 파라핀 왁스
용해도에 영향을 미치는 요인 :
* 온도 : 일반적으로 온도에 따라 용해도가 증가합니다 (고체 및 액체의 경우).
* 압력 : 가스의 용해도는 압력에 따라 증가합니다.
* 극성 : 위에서 언급했듯이 "처럼 녹아 버립니다."
* 분자간 힘 : 분자들 사이의 인력의 강도는 용해도에 영향을 미칩니다.
기억하십시오 : 일부 물질은 "불용성"으로 간주 되더라도 여전히 물에 아주 작은 정도로 용해 될 수 있습니다.