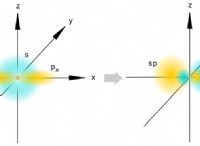
공명 구조 1
* 탄소는 산소에 대한 트리플 결합이 있습니다.
* Carbon has a lone pair of electrons.
* 산소에는 하나의 고독한 전자 쌍이 있습니다.
공명 구조 2
* 탄소는 산소에 대한 이중 결합이 있습니다.
* 탄소에는 두 개의 고독한 전자가 있습니다.
* 산소에는 두 개의 고독한 전자가 있습니다.
"최고의"루이스 구조는 무엇입니까?
CO의 실제 구조는 둘 다의 하이브리드이기 때문에 공명 구조는 진정으로 "최고"가 아닙니다. 이는 전자가 탄소 및 산소 원자에 대해 비편 재화되어 더 강력하고 안정적인 결합을 초래한다는 것을 의미합니다.
우리는 왜 공명 구조를 사용합니까?
* 전자의 탈소 화를 나타내는 것 : 공명 구조는 전자가 한 위치에 고정되어 있지 않고 오히려 분자 전체에서 움직임을 보여줍니다.
* 분자의 특성을 설명하기 위해 : CO에서 전자의 비편성은 강한 결합과 높은 용융 및 비등점에 기여합니다.
중요한 참고 : 실제로 CO는 이러한 공명 구조 중 하나에 존재하지 않습니다. 실제 구조는 혼합이며, 전자는 분자의 거동을보다 정확하게 표현하는 방식으로 두 원자에 분포되어 있습니다.