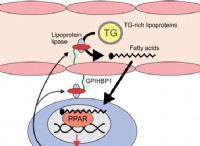
이유는 다음과 같습니다.
* 탄소의 본딩 : 탄소에는 4 개의 원자가 전자가있어 4 개의 결합을 형성 할 수 있습니다.
* 혼성화 : 탄소의 원자 궤도는 하이브리드 화하여 결합에 더 적합한 새로운 궤도를 형성합니다. 이러한 하이브리드 화 된 궤도는 특정 공간 배열로 지시된다.
* 일반적인 혼성화 :
* SP3 하이브리드 화 : 사면체로 연결됩니다 결합 각이 약 109.5 도의 기하학. 이것은 유기 화합물에서 탄소의 가장 일반적인 형상입니다.
* SP2 하이브리드 화 : trigonal 평면으로 연결됩니다 결합 각이 약 120 도의 기하학.
* SP 혼성화 : 선형 로 연결됩니다 결합 각인 180 도의 기하학.
* 선형 형상은 드물다 : SP 혼성화는 선형 기하학을 유발하지만 유기 화합물의 탄소에서는 매우 드 rare니다. 일반적으로 다음과 같은 경우에 발생합니다.
* alkynes : 삼중 결합에 관여하는 탄소 원자는 SP 혼성화를 가지며 선형입니다.
* Carbenes : 탄소에 대한 두 개의 결합 만있는 매우 반응성이 높은 종은 때때로 선형 기하학을 가질 수 있습니다.
요약 : 4 개의 결합과 공통 하이브리드 상태를 형성하는 탄소의 능력은 사면체, 삼각 평면 및 선형 기하학으로 이어진다. 그러나, 탄소가 다수의 결합을 형성하는 경향과 공통의 SP3 및 SP2 하이브리드 화로 인해 전형적인 유기 화합물에서 선형 기하학은 상대적으로 드물다.