동성애자에 따르면, Lussac은 주어진 질량의 가스에 의해 가해지고 일정한 부피로 유지되는 압력은 가스가 일정한 부피로 유지 될 때 (또는 일정한 질량으로 유지되고 일정한 부피로 유지 될 때 일정한 부피로 유지 될 때) 절대 온도와 직접적으로 다릅니다. 다시 말해, 가스의 질량이 고정되고 가스의 부피가 일정 할 때 가스에 의해 가해지는 압력은 가스의 온도에 비례합니다.
1808 년에 프랑스 화학자 인 조셉 게이-루이스 (Joseph Gay-Lussac)는이 법을 내놓았으며, 그는 그의 저널에 출판했습니다. 게이 법에 따르면, Lussac의 다음 수학적 표현은 다음과 같이 쓸 수 있습니다.
p ∝ t; p/t =k
여기서 :
가스에 의해 가해지는 압력은 문자 p로 표시됩니다.
가스의 절대 온도는 문자 t로 표시됩니다.
k는 일정합니다.
주어진 가스 질량의 압력과 절대 온도 사이의 관계의 그래픽 표현 (일정한 부피).
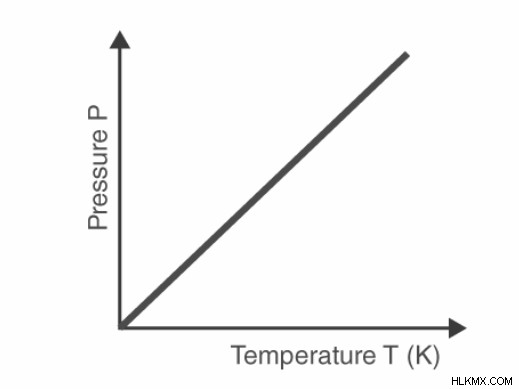
그래프를 기반으로, 가스가 결국 냉각되고 액체가 될 때까지 가스 (일정한 부피로 유지됨)의 압력이 냉각 될 때 지속적으로 감소한다는 것을 추론 할 수 있습니다.
.공식 및 파생
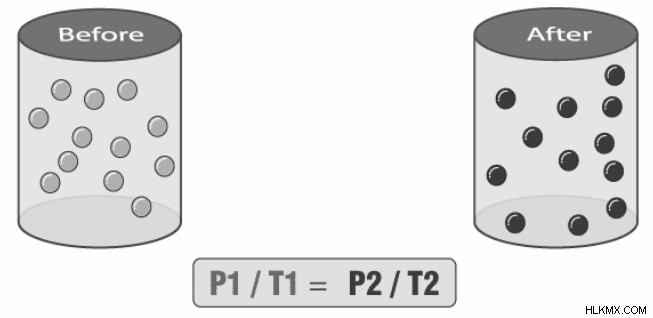
초기 압력과 온도와 온도와 최종 압력과 온도 사이의 관계로 인해 게이-법 Lussac은 초기 압력과 온도의 비율이 일정한 부피로 유지 된 고정 질량의 가스에 대한 최종 압력 및 온도의 비율과 같음을 의미합니다. 다음은이 공식에 대한 표현입니다.
(p1/t1) =(p2/t2)
여기서 :
초기 압력은 p1로 표시됩니다.
t1은 실험이 시작된 온도입니다.
최종 압력은 p2로 표시됩니다.
최종 온도는 t2로 표시됩니다.
가스와 관련 하여이 발현은 압력 온도 비례에서 파생 될 수 있습니다. 고정 질량이 있지만 부피가 일정한 가스의 경우 p ∝ t이므로 다음은 사실입니다.
p1/t1 =k 일 때 초기 압력/초기 온도가 일정하다는 것을 의미합니다.
최종 압력/최종 온도는 K와 같습니다 (최종 압력/최종 온도는 일정합니다).
결과적으로 p1/t1은 p2 =/t2와 같습니다.
또는 p1t2 =p2t1.
게이 법 Lussac 's는 다음 예에 의해 설명됩니다.
가압 에어로졸 컨테이너 (예를 들어, 탈취제 캔 또는 스프레이 페인트 캔)가 컨테이너의 가스에 의해 가해지는 압력의 증가로 인해 가열 될 때 폭발이 발생할 수 있습니다 (게이로 인해). 이러한 이유로, 많은 가압 컨테이너는 컨테이너가 화염에서 멀리 유지하고 시원한 환경에 저장해야한다는 경고 라벨이 장착되어 있습니다.
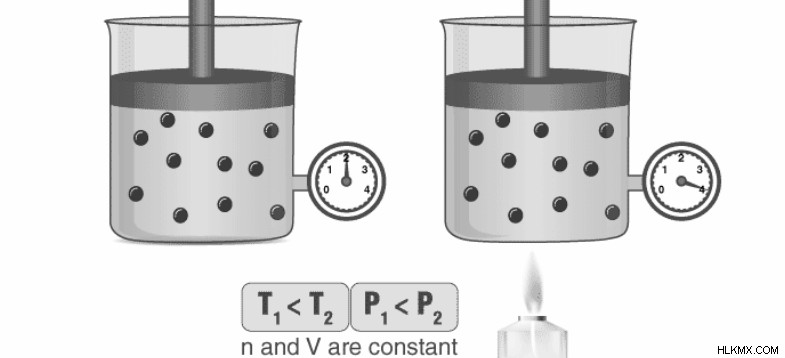
이 섹션에는 가스의 부피가 일정한 값으로 유지되는 동안 가스의 절대 온도가 높아질 때 발생하는 압력 증가를 설명하는 그림이 포함되어 있습니다. 압력솥을 사용할 때는 게이 법 Lussac을 또 다른 적용 할 수 있습니다. 쿠커가 가열 될 때 컨테이너 내부의 증기로 가해지는 압력이 증가하면 용기 내부의 압력이 증가합니다. 용기 내부의 고온과 압력 때문에 음식은 평소보다 더 빨리 요리됩니다.
결론
가스의 부피가 일정하게 유지 될 때, 게이 법률 Lussac은 주어진 가스 질량의 압력이 가스의 절대 온도에 직접 변하고 그 반대도 마찬가지라고 말합니다. 이상적인 가스 법률의 특별한 적용입니다. 밀폐 된 가스의 압력이 온도에 직접적으로 비례하고 그가 처음으로 공식화 한 압력법으로 알려진 Gay-Lussac은 압력법을 발견 한 것으로 인정됩니다. 또한, 그는 때때로 일정한 부피로 유지되는 고정 된 가스 질량의 압력과 온도 사이의 관계를 보여주는 설득력있는 증거를 최초로 출판 한 것으로 인정됩니다.
.