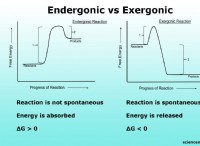
NA2S2O3과 HCL 사이의 화학 동역학 판독 값
티오 설페이트 나트륨 (NA2S2O3)과 염산 (HCL) 사이의 반응은 화학 동역학을 연구하는 데 사용되는 전형적인 예입니다. 다음은 반응의 고장, 당신이 얻을 수있는 독서 및 그들이 우리에게 말하는 것입니다.
반응 :
* 방정식 : NA2S2O3 (AQ) + 2HCL (AQ) → 2NACL (AQ) + H2O (L) + SO2 (G) + S (S)
* 주요 관찰 :
* 반응은 흐린 황 침전물을 형성합니다.
* 이산화황 (SO2) 가스도 생산됩니다.
* 반응은 실온에서 천천히 진행되므로 타이밍이 쉽습니다.
획득하기위한 판독 값 :
1. 시간 :
* 반응 혼합물이 특정 탁도 지점 (흐림)에 도달하기 위해 취한 시간을 측정하려면 스톱워치를 사용하십시오. 반응 플라스크 아래에있는 십자가를 사용하고 십자가가 가려지는 시점을 관찰 할 수 있습니다.
2. 농도 :
* 다른 상수를 유지하면서 Na2S2O3 또는 HCl의 농도를 변경합니다. 이를 통해 농도가 반응 속도에 어떤 영향을 미치는지 연구 할 수 있습니다.
3. 온도 :
* 다른 온도 (수조 또는 기타 방법 사용)에서 반응을 수행하십시오. 이를 통해 반응 속도에 대한 온도의 영향을 연구 할 수 있습니다.
4. 촉매 (선택 사항) :
* 구리 (II) 이온과 같은 촉매를 추가하여 반응 속도에 어떤 영향을 미치는지 확인할 수 있습니다.
데이터 분석 :
* 법률 : 시간 및 농도 데이터를 사용하여 반응의 속도 법칙을 결정할 수 있으며, 이는 각 반응물에 대한 반응 순서를 알려줍니다.
* 속도 상수 (k) : 데이터를 적절하게 플로팅하면 주어진 온도에서 반응이 얼마나 빨리 진행되는지를 측정하는 속도 상수 (k)를 얻을 수 있습니다.
* 활성화 에너지 (EA) : Arrhenius 방정식을 사용하여 반응물이 생성물을 형성하는 데 필요한 최소 에너지 인 반응의 활성화 에너지를 결정할 수 있습니다.
예제 결과 :
* 농도 : Na2S2O3 또는 HCl의 농도를 증가 시키면 일반적으로 더 빠른 반응 속도가 발생할 수 있습니다.
* 온도 : 온도를 높이면 반응 속도가 증가합니다. 이것은 더 높은 온도가 분자가 활성화 에너지 장벽을 극복 할 수 있도록 더 많은 에너지를 제공하기 때문입니다.
* 촉매 : 촉매는 전형적으로 활성화 에너지가 낮은 대안 경로를 제공함으로써 반응 속도를 가속화 할 것이다.
중요한 메모 :
* 일관된 결과를 보장하기 위해 반응 혼합물의 부피를 일정하게 유지하는 것이 중요합니다.
* 균일 한 농도를 보장하기 위해 반응을 시작하기 전에 용액을 철저히 혼합하십시오.
* 결과의 정확성과 신뢰성을 보장하기 위해 실험을 여러 번 반복하십시오.
이 실험에서 데이터를 신중하게 수집하고 분석함으로써 화학 반응 속도에 영향을 미치는 요인에 대한 귀중한 통찰력을 얻을 수 있습니다.