이온 형성 설명 :간단한 비유
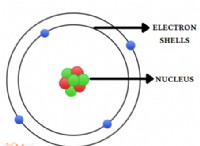
작고 완벽하게 균형 잡힌 시소와 같은 원자를 상상해보십시오. 그들은 핵에 특정 수의 양으로 하전 된 양성자를 가지고 있으며 주위에 공전하는 음으로 하전 된 전자가 있습니다. 양성자와 전자의 수가 같으면, 시소는 완벽하게 균형을 이루고 원자는 중립적입니다.
이제, 시소의 한쪽에 무게를 추가한다고 상상해보십시오. 이것은 원자에서 전자를 추가하거나 제거하는 것과 같습니다.
* 전자를 추가하면 시소는 여분의 전자로 측면에 기울어지면서 음의 이온 를 만듭니다. . 이것은 음으로 하전 된 전자가 양으로 하전 된 양성자를 능가하기 때문에 발생합니다.
* 전자를 제거하면 시소는 전자가 적은 측면에 기울어지면서 양의 이온을 만듭니다. . 이것은 긍정적으로 하전 된 양성자가 음으로 하전 된 전자를 능가하기 때문에 발생합니다.
여기에 더 자세한 설명이 있습니다 :
이온의 형성 :
* 원자가 안정성을 위해 노력합니다 : 원자는 자연스럽게 가장 바깥 쪽 쉘 ( "원자가 쉘")에서 전자의 안정적인 구성을 달성하기를 원합니다.
* 전자 얻기 또는 손실 : 안정성을 달성하기 위해, 원자는 원자가 껍질을 채우기 위해 전자를 얻거나 잃을 수있어 이온이 형성 될 수있다.
* 금속은 전자를 잃는 경향이 있습니다 : 금속은 일반적으로 원자가 껍질에 1, 2 또는 3 개의 전자가 있습니다. 그들은이 전자를 잃어 버려서 양이온이 양이온이되기 위해 경향이 있습니다.
* 비금속은 전자를 얻는 경향이 있습니다 : 비금속은 일반적으로 원자가 쉘에 5, 6 또는 7 개의 전자를 갖습니다. 그들은 원자가 껍질을 채우고 음의 전하 음이온이되는 전자를 얻는 경향이 있습니다.
예 :
* 나트륨 (NA)은 Na+:가되기 위해 하나의 전자를 잃습니다 나트륨은 가장 바깥 쪽 쉘에 전자 하나가 있습니다. 이 전자를 잃어 버림으로써 고귀한 가스 네온과 같은 안정적인 구성을 달성합니다.
* 염소 (Cl)는 하나의 전자를 얻기 위해 하나의 전자를 얻습니다 염소는 가장 바깥 쪽 껍질에 7 개의 전자가 있습니다. 하나의 전자를 얻음으로써 고귀한 가스 아르곤과 같은 안정적인 구성을 달성합니다.
결론 :
이온 형성은 화학의 기본 과정입니다. 안정성을 달성하기 위해 원자가 전자를 얻거나 잃는 방법을 이해함으로써, 우리는 다양한 이온과 그 특성의 형성을 예측할 수 있습니다.