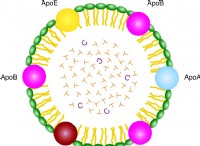
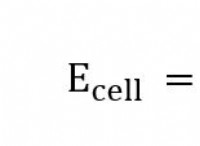이것이 중요한 이유는 다음과 같습니다.
* 안정성 : 가장 바깥 쪽 쉘 (원자가 쉘이라고도 함)은 가장 안정적인 전자 구성입니다. 이것이 고귀한 가스가 극도로 반응하지 않으며 모나상 가스로 존재하는 이유입니다.
* 옥트 규칙 : 8 전자의 전체 외부 쉘을 달성하기 위해 원자가 전자를 얻거나 잃거나 공유하는 경향은 옥트 규칙으로 알려져 있습니다. 고귀한 가스는 자연스럽게이 구성을 가지고있어 규칙의 이상적인 예입니다.
* 시각적 표현 : Bohr 다이어그램은 채워진 외부 쉘을 명확하게 설명하여 고귀한 가스의 안정성을 시각적으로 강조합니다.
예를 들어 봅시다 :
* 네온 (NE) : 네온은 첫 번째 쉘에 2 개의 전자와 두 번째 쉘에 8 개의 전자를 가지고 있습니다. 이 완전한 두 번째 쉘은 Bohr 다이어그램으로 표시되어 핵 주위에 8 개의 도트가 표시됩니다.
이 특수 구성은 고귀한 가스의 화학적 거동과 화학적 결합의 원리를 이해하는 열쇠입니다.