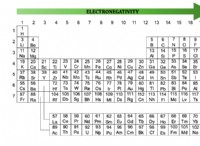
* 산 물에 용해 될 때 수소 이온 (H+)을 방출합니다.
* 베이스 물에 용해 될 때 수산화 이온 (OH-)을 방출하십시오.
산 및 염기가 반응 할 때, 산으로부터의 H+ 이온은 염기로부터의 옴과 결합하여 물을 형성한다 (H2O). 이것은 남은 이온을 산과 염기에서 남겨두고 염 를 결합하고 형성합니다. .
다음은 간단한 예입니다.
* 염산 (HCl) + 수산화 나트륨 (NAOH) -> 염화나트륨 (NaCl) + 물 (H2O)
* HCl은 H+ 및 Clients를 출시합니다.
* NAOH는 NA+ 및 OHION을 방출합니다.
* H+와 OH- 결합하여 물을 형성합니다.
* 나머지 Na+와 Cl- 조합은 염화나트륨 (NaCl)을 형성하는데, 이는 소금이다.
왜 다른 소금?
형성된 염의 유형은 반응에 사용 된 특정 산 및 염기에 의존한다. 이유는 다음과 같습니다.
* 다른 산 상이한 음이온을 방출한다 (예를 들어, 하이드로 클로르산으로부터의 Cl-, 황산으로부터 SO42-).
* 다른베이스 상이한 양이온을 방출한다 (예를 들어, 수산화 나트륨으로부터의 Na+, 수산화 칼슘으로부터 Ca2+).
따라서, 이러한 다른 음이온과 양이온의 조합은 상이한 염의 형성으로 이어질 것이다.
여기에 몇 가지 더 많은 예가 있습니다 :
* 질산 (HNO3) + 수산화 칼륨 (KOH) -> 질산 칼륨 (KNO3) + 물 (H2O)
* 황산 (H2SO4) + 수산화 바륨 (BA (OH) 2) -> 황산 바륨 (Baso4) + 물 (H2O)
보시다시피, 각 반응에서 형성된 염은 반응 산 및 염기로부터의 음이온 및 양이온의 변화로 인해 상이하다.