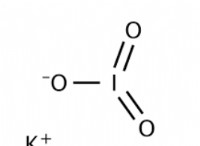
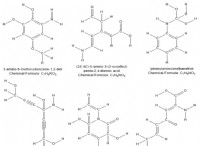
일반 방정식은 다음과 같습니다.
hx (aq) + h2o (l) ⇌ h3o + (aq) + x- (aq)
어디:
* hx 할로겐 산 (HF, HCL, HBR, HI)을 나타냅니다.
* H2O 물을 나타냅니다
* H3O+ 하이드로 늄 이온을 나타냅니다
* x- 할라이드 음이온 (F-, Cl-, br-, i-)을 나타냅니다.
특정 예 :
* 히드로 플루오르 산 (HF) :
hf (aq) + h2o (l) ⇌ h3o + (aq) + f- (aq)
* 염산 (HCl) :
HCl (AQ) + H2O (L) ⇌ H3O + (AQ) + Cl- (AQ)
* Hydrobromic Acid (HBR) :
hbr (aq) + h2o (l) ⇌ h3o + (aq) + br- (aq)
* hydroiodic acid (hi) :
안녕 (aq) + h2o (l) ⇌ h3o + (aq) + i- (aq)
이러한 반응은 가역적이다 평형 를 확립한다 . 그러나, 할로겐산은 강산이다 , 그들이 물에 거의 완전히 분리되는 것을 의미하므로, 평형은 오른쪽에 크게 놓여있어 히드로 늄 이온과 할라이드 음이온의 형성에 유리합니다.