기본 규칙 :
* 요소는 그들의 상징으로 표시됩니다. 예를 들어, 수소는 H이고, 산소는 O이고, 탄소는 C입니다.
* 하위 스크립트는 화합물의 각 원소의 원자 수를 나타냅니다. 원자가 하나만 있으면 첨자가 쓰여지지 않습니다.
* 공식은 화합물에서 원자의 가장 간단한 전체 수를 나타냅니다.
화학 공식의 유형 :
* 경험적 공식 : 화합물에서 원자의 가장 간단한 전체 수치 비율을 보여줍니다. 예를 들어, 포도당의 경험적 공식은 ch₂o입니다.
* 분자식 : 분자에서 각 원소의 실제 원자 수를 보여줍니다. 예를 들어, 포도당의 분자 공식은 c₆h₁₂o₆입니다.
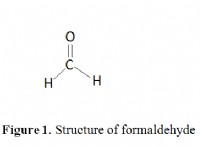
* 구조 공식 : 결합을 나타내는 라인을 사용하여 분자 내에서 원자의 배열을 보여줍니다.
작성 화학 공식 :
1. 관련된 요소를 식별하십시오.
2. 이온의 전하를 결정하십시오 (해당되는 경우) 이것은 중성 화합물을 형성하는 데 필요한 각 이온의 수를 이해하는 데 도움이됩니다.
3. 요금의 가장 일반적인 배수를 찾으십시오. 이것은 충전의 균형을 맞추는 데 필요한 각 이온의 수를 결정합니다.
4. 요소의 기호를 씁니다.
5. 가장 일반적인 배수 청구를 기준으로 각 요소의 위시를 작성하십시오.
6. 공식이 가장 단순한 전체 수비율인지 확인하십시오.
예 :
* 물 (h>o) : 2 개의 수소 원자 (H) 및 1 개의 산소 원자 (O).
* 염화나트륨 (NaCl) : 하나의 나트륨 원자 (NA) 및 하나의 염소 원자 (CL).
* 이산화탄소 (Co₂) : 하나의 탄소 원자 (C) 및 2 개의 산소 원자 (O).
* 클로라이드 칼슘 (Cacl₂) : 하나의 칼슘 원자 (Ca) 및 2 개의 염소 원자 (CL).
* 포도당 (c₆h₁₂o₆) : 6 개의 탄소 원자 (C), 12 개의 수소 원자 (H) 및 6 개의 산소 원자 (O).
중요한 메모 :
* 다 원자 이온 : 이들은 전하를 갖는 단일 단위 역할을하는 원자 그룹이다. 공식을 쓸 때 단일 요소처럼 취급하십시오. 예를 들어, 황산염 이온 (SO₄²⁻)은 -2 전하를 갖는다.
* 산 : 일반적으로 산은 수소 (H) 및 비금속 또는 다 원소 이온을 함유한다. 산에 대한 공식은 종종 "H"와 비금속 또는 다 원자 이온 기호로 시작합니다. 예를 들어, 염산은 HCl입니다.
* 금속 산화물 : 많은 금속 산화물은 MO의 일반적인 패턴을 따릅니다 (여기서 M은 금속을 나타냅니다). 예를 들어, 산화 마그네슘은 MGO입니다.
실습 및 자원 :
* 공통 요소와 이온을 가진 화학 공식을 쓰는 연습.
* 요소 기호 및 전하에 대한 주기율표를 참조하십시오.
* 추가 예제 및 설명을 위해 온라인 리소스 및 교과서를 사용하십시오.
화학 공식 작성에 대한 구체적인 질문이 있으면 알려주세요!