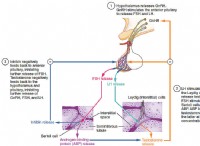
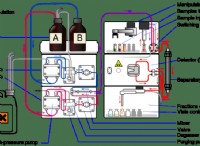
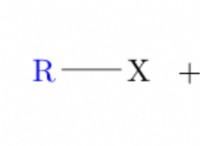재료 :
* 클로라이드 소금 샘플 (예 :NaCl)
* 질산은의 표준 용액 (Agno3)
* 칼륨 크로메이트 (K2CRO4) 용액 (지표)
* 탈 이온수
* Burette
* erlenmeyer flask
* 피펫
* 비이커
절차 :
1. 솔루션 준비 :
* 표준 AGNO3 솔루션 : 알려진은 농도의 질산 질산염 용액 (예를 들어, 0.1m)을 준비하십시오.
* K2CRO4 솔루션 : 칼륨 크로메이트의 희석액을 준비하십시오 (지표).
2. 샘플의 무게 : 클로라이드 염 샘플의 알려진 질량 (예를 들어, 0.2 g)을 정확하게 무게를 측정하고이를 Erlenmeyer 플라스크에 탈 이온수에 녹인다.
3. 적정 :
* 클로라이드 염 용액에 몇 방울의 칼륨 크로메이트 용액을 첨가하십시오. 솔루션은 노란색으로 변합니다.
* 표준 AGNO3 솔루션으로 뷰렛을 채우십시오.
* 플라스크를 끊임없이 소용돌이 치는 동안 Burette에서 염화물 용액에 AgNO3 용액을 천천히 첨가하십시오.
* 솔루션에 은색 크로메이트 (AG2CRO4)의 영구적 인 적갈색 침전물이 나타날 때 종말점에 도달합니다.
* 종말점에 도달하는 데 사용되는 AGNO3 용액의 부피를 기록하십시오.
4. 계산 :
* AGNO3 용액의 부피 및 몰도를 사용하여 적정에 사용 된 AGNO3의 두더지를 계산하십시오.
* 질산은과 염화물 이온 사이의 반응은 다음과 같습니다.
* agno3 (aq) + cl- (aq) → agcl (s) + no3- (aq)
* 반응은 1 :1이기 때문에, 사용 된 AgNO3의 두더지는 샘플에서 클로라이드 이온 (Cl-)의 두더지와 동일하다.
* 몰 질량 (35.45 g/mol)을 사용하여 샘플에서 클로라이드 이온의 질량을 계산하십시오.
* 다음 공식을 사용하여 염화염의 순도 백분율을 계산하십시오.
% 순도 =(샘플의 샘플 / 질량에서 클로라이드 이온의 질량) x 100
종말점의 설명 :
* 칼륨 크로메이트 용액은 지표로 작용합니다. 처음에는 노란색 용액을 형성합니다.
* 샘플의 모든 클로라이드 이온이은 이온과 반응했을 때, 추가 AgnO3의 첨가는은 크로메이트의 적색 갈색 침전물의 형성을 유발할 것이다 (AG2CRO4).
*이 침전물의 모양은 적정의 종말점을 표시하여 모든 염화물 이온이 반응했음을 나타냅니다.
키 포인트 :
* MOHR 방법은 중성 용액에서 염화물 이온 농도를 결정하는 데 가장 적합합니다.
* 솔루션의 pH는 정확한 결과를 얻으려면 6.5에서 9.0 사이 여야합니다.
* 종말점은 주관적이며 색상 변화를 감지하는 관찰자의 능력에 따라 다릅니다.
*이 방법은 신중하고 적절한 기술로 수행하면 정확하고 정확합니다.
이 단계를 수행함으로써 MOHR 방법을 사용하여 염화염의 순도 백분율을 결정할 수 있습니다.