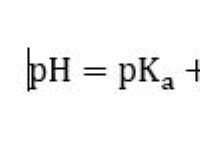1. 부정적인 엔탈피 변화 (ΔH) 사용 :
* ΔH <0 : 이것은 제품의 엔탈피가 반응물의 엔탈피보다 낮다는 것을 의미합니다. 엔탈피는 열 함량의 척도이기 때문에 부정적인 변화는 반응에 의해 열이 방출됨을 나타냅니다.
* 예 :
* 메탄의 연소 :ch₄ (g) + 2o₂ (g) → co₂ (g) + 2h₂o (l) ΔH =-890.3 kJ/mol
2. 제품으로 열 항을 추가 :
* 이것은 열이 반응의 산물로 방출되고 있음을 명시 적으로 보여줍니다.
* 예 :
* 중화 반응 :h :(aq) + Oh a (aq) → h₂o (l) + 열
중요한 참고 :
* 두 방법 모두 동일한 정보를 전달합니다. 반응이 열을 방출합니다.
* 엔탈피 변화 (ΔH)의 특정 값은 소비 된 반응물 몰당 방출 된 열량을 제공합니다.
더 많은 예제 나 설명을 원하시면 알려주세요!