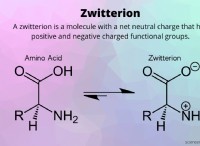
1. 물에 용해 된 염 (전해질 용액)
* 전도도가 증가합니다. 염은 물에 용해 될 때 이온 (Na+ 및 Cl-)으로 분리됩니다. 이들 이온은 전하 담체로서 작용하여 용액의 전기 전도성을 증가시킨다. 이를 통해 전기 전류가 전해질을 통해보다 쉽게 흐르고 전기 분해를 용이하게합니다.
* 반응을 용이하게합니다 : 이온의 존재는 전기 분해 동안 전극에서 발생하는 전기 화학 반응에 대한 반응물을 제공한다. 예를 들어, 소금으로 물의 전기 분해에서, 클로온은 양극에서 산화되어 염소 가스를 생성하는 반면, 물의 H+ 이온은 음극에서 감소하여 수소 가스를 생성한다.
* 제품 형성 변경 : 전해질 용액에 존재하는 이온의 유형은 전기 분해 생성물에 영향을 줄 수 있습니다. 예를 들어, 소금물 (짠 물)의 전기 분해에서, 염소 가스는 산소 대신 양극에서 생성되며, 이는 순수한 물만 사용되면 생산됩니다.
2. 고체 염 (고체 전해질을 갖는 전해 세포)
* 전해질 : 고체 염은 특수 전해 세포에서 전해질로서 작용하여 결정 격자를 통해 이온의 움직임을 허용 할 수있다. 그러나, 고체 염의 전도도는 수용액의 전도도보다 훨씬 낮으므로 공정이 덜 효율적이다.
* 전기 분해 : 고체 소금은 직접 전해질 수 있지만 전도도가 낮기 때문에 공정이 종종 덜 실용적입니다.
키 포인트 :
* 소금은 수용액에서 효율적인 전기 분해에 필수적입니다. 전도도를 증가시키고, 반응물을 제공하며, 제품을 변경합니다.
* 소금은 고체 전해질 역할을 할 수 있지만 전도도는 낮습니다.
* 전기 분해에 대한 SALT의 특정 효과는 농도, 전해질의 유형 및 적용된 전압에 달려 있습니다. .
예 :
소금물 (짠 물)의 전기 분해에서 다음과 같은 반응이 발생합니다.
* 양극 : 2CL- → CL2 + 2E- (염소 가스가 생산됩니다)
* 음극 : 2H + + 2E- → H2 (수소 가스 생산)
이 과정은 소금 이온의 존재 없이는 불가능할 것이며, 이는 반응이 발생하기 위해 필요한 반응물을 제공한다.
결론적으로, 소금은 전기 분해에서 중요한 역할을하며, 많은 전해 공정에 중요한 성분이된다.