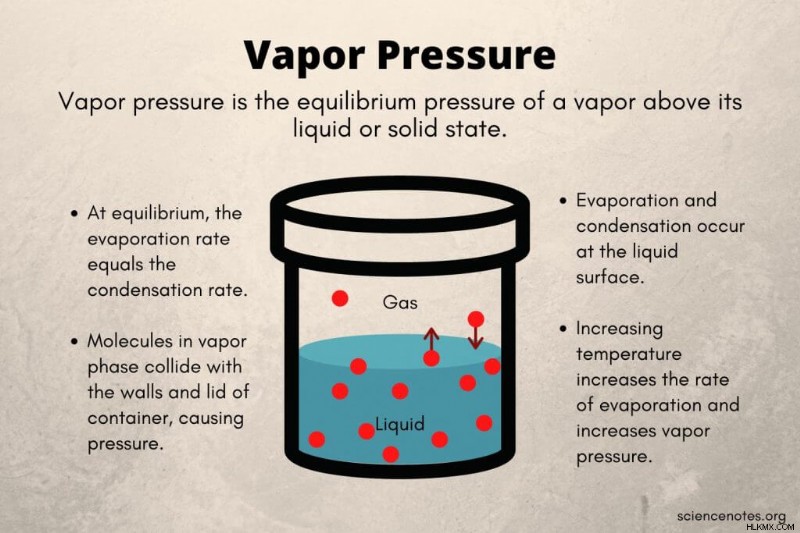
증기 압력 (또는 증기 압력)은 닫힌 용기에서 액체 또는 고체 상태 위의 증기의 평형 압력입니다. 이러한 유형의 폐쇄 시스템에서, 액체 또는 고체의 일부 분자는 표면에서 탈출하여 증기 (가스) 단계로 들어갈 수있는 충분한 운동 에너지를 갖는다. 한편, 일부 증기 분자는 액체 또는 고체 표면과 충돌하여 상을 변화시킨다. 증기 분자의 운동 에너지는 용기의 벽과 뚜껑에 부딪쳐 증기 압력을 생성합니다.
.액체 (또는 고체)를 벗어나는 분자의 수가 증기 상에서 액체 (또는 고체)로 되돌아가는 분자의 수와 같다. . 닫힌 용기에서, 증발 속도와 응축 속도는 포화 증기 압력에서 동일합니다. 열린 용기에서는 온도가 비등점에 도달 할 때까지 온도가 증가함에 따라 증기 압력이 상승합니다. 포화 증기압은 비등점 온도에서 발생하며, 이는 대기압에 따라 다릅니다. 따라서, 1 기압의 압력에서, 물의 포화 증기 압력은 100 c (212F)에서 발생한다. 다시 말해, 증기 압력은 액체의 끓는점에서 대기압과 같습니다.
증기압이 높은 물질은 휘발성 이라고합니다. . 휘발성 물질의 예로는 가솔린 및 문지르는 알코올 (액체) 및 파라디클로로 벤젠 (고체)이 있습니다. 열린 용기에서, 증기로서 탈출하는 액체 분자는 용기에 부딪치지 않고 평형 압력에 도달합니다. 대신, 증기 분자가 증발합니다. 비 휘발성 액체는 물보다 낮은 증기 압력을 가지며 천천히 증발합니다. 휘발성 액체는 증기압이 높고 빠르게 증발합니다.
증기 압력에 영향을 미치는 요인
증기 압력에 영향을 미치는 가장 중요한 요소는 온도와 분자 유형입니다.
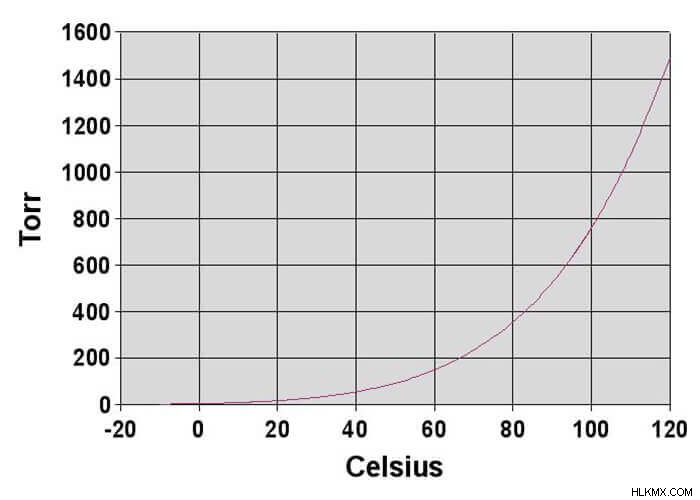
- 온도 :온도는 증기 압력에 가장 큰 영향을 미칩니다. 온도가 증가함에 따라 증기 압력이 증가합니다. 온도가 감소함에 따라 증기 압력이 감소합니다. 열 에너지를 부여하면 분자에 더 많은 운동 에너지가 제공되므로 이것은 의미가 있습니다. 증기압과 온도의 관계 그래프는 곡선입니다. 그러나 증기 압력 대 온도의 자연 로그의 그래프는 직선입니다.
- 분자간 힘 :분자와 물질의 화학적 조성 사이의 힘은 증기압에 영향을 미칩니다. 예를 들어, 물은 강한 수소 결합을 함유하므로 분자 사이에 작용하는 분자간 힘이 약한 가솔린보다 증기압이 낮습니다.
이 아닌 요인도 있습니다 증기 압력에 영향을 미칩니다 :
- 액체 또는 고체의 양 :물질의 양은 물질의 증기 압력에 영향을 미치지 않습니다. 예를 들어, 물방울의 증기 압력은 물 풀의 증기 압력과 동일합니다.
- 표면적 :표면적은 증기 압력에 영향을 미치지 않습니다. 그러나 증발은 작은 표면적보다 큰 표면적으로 훨씬 더 빨리 발생합니다. 예를 들어, 유리의 물은 카운터에 쏟아진 같은 양의 물보다 증발하는 데 시간이 오래 걸립니다.
물의 증기 압력
물의 증기 압력은 온도에 따라 다릅니다. 실온 (25C)에서의 물의 증기 압력은 23.8 mm Hg, 0.0313 ATM 또는 23.8 Torr 또는 3.17 kPa입니다. 동결 지점 (0 C)에서 물의 증기 압력은 4.6 토르입니다. 끓는점 (100 C)에서 물의 증기 압력은 658.0 Torr (대기압)입니다.
증기 압력 값 표
이 표는 실내 온도 근처의 액체의 증기 압력 값 (20-25C 또는 68-77 f)을 나열합니다.
| 액체 | 증기 압력 (KPA) |
| acetaldehyde | 120 |
| 아세트산 | 2.1 |
| 아세톤 | 30 |
| 아밀 아세테이트 | 0.47 |
| aniline | 0.09 |
| 맥주 | 2.4 |
| 벤젠 | 14 |
| Bromine | 28 |
| 1- 부탄올 | 0.93 |
| 이황화 탄소 | 48 |
| 탄소 테트라 클로라이드 | 15.3 |
| 클로로포름 | 26 |
| 사이클로 헥사 놀 | 0.9 |
| 에탄올 | 12.4 |
| 에틸렌 글리콜 | 0.007 |
| 포름 산 | 5.7 |
| 이소 프로필 알코올 | 4.4 |
| 등유 | 0.7 |
| 메탄올 | 16.9 |
| 우유 | 2.4 |
| 니트로 벤젠 | 0.03 |
| 옥탄 | 1.9 |
| 펜탄 | 58 |
| 페놀 | 0.05 |
| 해수 | 2.4 |
| 스티렌 | 0.85 |
| 테트라 클로로 에탄 | 0.7 |
| 테트라 클로로 에틸렌 | 2.5 |
| 톨루엔 | 3.8 |
| Trichlorethylene | 9.2 |
| 물 | 2.4 |







