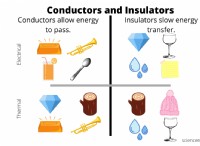
* 화학 방정식 :
* ca (OH)) (들)은 고체 수산화 칼슘을 나타냅니다.
* Ca²⁺ (aq)는 물에 용해 된 칼슘 이온을 나타냅니다.
* 2oh a (aq)는 물에 용해 된 수산화 이온을 나타냅니다.
* 반응은 흡열입니다 : 엔탈피 변화 (ΔH)는 -16.71 kJ/mol입니다. 부정적인 엔탈피 변화는 반응 가 열을 흡수 함을 나타냅니다. 주변 환경에서 흡열성을 만듭니다.
반응이 밝혀진 것 :
* 수산화 칼슘은 물에 가용성이 있습니다 : 반응은 고체 Ca (OH) ₂가 물에 넣을 때 이온 성분 (Ca²⁺ 및 OH⁻)에 용해됨을 보여준다.
* 용해 과정은 흡열입니다 : 이것은 반응이 발생하기 위해 에너지가 시스템에 (열과 같은) 추가되어야 함을 의미합니다.
* 수산화 칼슘은 기본 솔루션을 형성합니다. Ca (OH))가 용해되면 용액의 기본 (알칼리성) 특성을 담당하는 수산화 이온 (OHA)을 생성합니다.
요약 :
반응은 수산화 칼슘이 물에 용해되고 그 용해가 흡열 과정으로 기본 용액을 형성한다는 것을 보여준다.