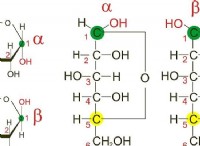
용해도 이해
* 극성 용매 물처럼 물에는 고르지 않은 전하 분포가있는 분자가있어 양성 및 음의 극을 생성합니다.
* 이온 성 화합물 질산은은 양으로 하전 된 양이온 (Ag⁺) 및 음으로 하전 된 음이온 (NOI)으로 만들어집니다.
질산은이 더 용해 된 이유
1. 더 강한 이온 상호 작용 : 은 질산염은은 이온 (Ag⁺) 및 질산염 이온 (NOA)의 높은 전하 밀도로 인해 강한 이온 성 결합을 형성합니다. 이 이온들 사이의 이러한 강력한 인력은 극 용매가 이온 격자를 분리하고 화합물을 용해시키는 것을 더 쉽게 할 수있게한다.
2. 용매와의 유리한 상호 작용 : 극성 용매는 질산은의 하전 된 이온과 유리하게 상호 작용할 수있다. 용매 분자의 양성 극은 질산염 음이온으로 끌릴 것이며, 음성 극은은 양이온에 끌릴 것이다.
클로라이드 탄산염이 존재하지 않는 이유 (그리고 용해도에 대한 영향)
* 클로라이드 카보네이트 (Cl₂co₃)는 매우 불안정한 화합물 일 것입니다. 탄산염 (Co⁻²₃)은 클로라이드 이온 (CL)과 쉽게 반응하는 것으로 알려져 있으며, 다른 생성물의 형성으로 이어진다. 이 불안정성은 염화 탄산염이 용액에서 안정적인 화합물로 존재하지 않기 때문에 용해도는 관련이 없음을 의미합니다.
요약 :
질산은은 강한 이온 결합과 하전 된 이온과 극 용매 분자 사이의 유리한 상호 작용으로 인해 극성 용매에 더 용해됩니다. 반면에 클로라이드 탄산염은 안정적인 화합물이 아니므로 용해도 측면에서 논의 될 수 없습니다.