이온 및 공유 결합 :공유 대 전달 전자
이온 결합 및 공유 결합 분자와 화합물을 형성하기 위해 원자를 함께 유지하는 두 가지 주요 유형의 화학적 결합입니다. 전자를 공유하거나 전달하는 방식이 다릅니다.
이온 결합 :
* 형성 : A 금속 사이에 발생합니다 및 비-비-메탈 원자.
* 메커니즘 : 금속 원자는 하나 이상의 전자 를 잃습니다 긍정적으로 하전 된 양이온이되기 위해 . 비금속 원자는 이들 전자를 얻는다 음의 음이온 가되기 위해 . 반대의 요금은 서로를 끌어 들이고 정전기 인력을 형성합니다 그것은 그들을 함께 붙잡고 있습니다.
* 특성 :
* 강한 정전기 인력으로 인한 높은 용융 및 끓는점.
* 일반적으로 실온에서 고체로 존재합니다.
* 종종 물에 용해됩니다.
* 물이나 용융 상태에 용해 될 때 전기 도체가 우수합니다.
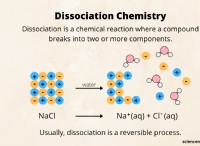
* 예 : 염화나트륨 (NaCl). 나트륨 (NA)은 Na+가되기 위해 전자를 잃고, 염소 (Cl)는 전자를 얻기 위해 전자를 얻습니다. Na+와 Cl- 사이의 정전기 인력은 이온 결합을 형성한다.
공유 결합 :
* 형성 : 비금속 원자 사이에 발생합니다 오직.
* 메커니즘 : 원자 공유 전자 가장 바깥 쪽 쉘이 채워진 안정적인 전자 구성을 달성합니다.
* 특성 :
* 이온 성 화합물에 비해 용융 및 끓는점이 낮습니다.
* 실온에서 고체, 액체 또는 가스로 존재할 수 있습니다.
* 일반적으로 물에 용해되지 않습니다.
* 전기 도체가 좋지 않습니다.
* 예 : 물 (H2O). 각각의 수소 (H) 원자는 산소 (O) 원자와 하나의 전자를 공유하여 2 개의 공유 결합을 형성한다.
다음은 주요 차이점을 요약 한 표입니다.
| 기능 | 이온 결합 | 공유 본드 |
| ------------------- | ------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
| 형성 | 금속 및 비금속 | 비금속 및 비금속 |
| 전자 전송 | 전자가 전달됩니다 | 전자는 공유됩니다 |
| 채권 유형 | 정전기 인력 | 공유 전자 쌍 |
| 용융/끓는 | 높은 | 더 낮은 |
| 실온에서 상태 | 솔리드 | 고체, 액체 또는 가스 |
| 수용성 | 종종 가용성 | 일반적으로 용해되지 않습니다 |
| 전도도 | 용해되거나 녹을 때 좋습니다 | 가난한 |
주목하는 것이 중요합니다 :
* 원자 사이의 결합이 이온 성 및 공유 결합의 특성을 갖는 경우가 있습니다. 이것을 극성 공유 결합 라고합니다 . 이 경우, 전자는 동일하게 공유되지 않으므로 원자에 부분 양성 및 부분 음전하가 발생합니다.
* 두 원자 사이에 형성된 결합의 유형은 이들 사이의 전기 음성 차이에 따라 다릅니다. 전기 음성 성의 큰 차이는 이온 결합으로 이어지는 반면, 작은 차이는 공유 결합으로 이어진다.
화학에서 다른 물질의 특성과 거동을 이해하는 데 이온 성과 공유 결합의 차이를 이해하는 것이 중요합니다.