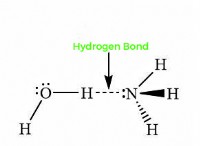
산도 이해
* 산도는 양성자 (H+) 를 잃는 것입니다 :분자가 쉽게 양성자를 잃을수록 산이 강해집니다.
* 전자 철수 그룹 (EWG)은 산을 강하게 만듭니다 :EWGS는 산성 양성자로부터 전자 밀도를 빼내어 제거하기가 더 쉬워집니다.
* 전자 기증 그룹 (EDG)은 산을 약하게 만듭니다 :EDGS는 전자 밀도를 산성 양성자쪽으로 밀어 제거하기가 더 어려워집니다.
산도를 감소시키는 기능 그룹
다음은 EDG로 작용하여 유기 분자를 덜 산성으로 만드는 기능 그룹입니다.
* 알킬기 (-ch3, -ch2ch3 등) : 이들 그룹은 유도 적 전자 기증이며, 이는 전자 밀도를 산성 양성자쪽으로 밀어 넣는다는 것을 의미한다. 이것은 양성자를 제거 할 가능성이 적어 분자가 덜 산성으로 만듭니다.
* 알콕시 그룹 (-or) : 이들 그룹은 또한 산소 원자가 전자를 기증하는 능력으로 인해 유도 적 전자 기증이다.
* 아민 (-nh2, -nhr, -nr2) : 알콕시 그룹과 유사하게, 아민의 질소 원자는 전자를 기증하여 분자를 덜 산성으로 만듭니다.
* 아미드 (-conh2) : 카르 보닐기가 전자 철수하는 반면, 질소 원자는 전자를 기증하여 분자가 전체적으로 덜 산성을 만들 수있다.
예
아세트산 (CH3COOH)과 알킬 그룹을 첨가하는 것이 산도에 미치는 영향을 고려해 봅시다.
* 아세트산 (CH3COOH) : 적당히 강한 산.
* 프로 파노 산 (CH3CH2COOH) : 에틸기 (CH3CH2-)는 전자 밀도를 산성 양성자쪽으로 밀어 제거하기 때문에 아세트산보다 약간 약합니다.
중요한 메모 :
* EDG의 강점이 중요합니다. 더 강한 EDG는 산도 감소에 더 큰 영향을 미칩니다.
* 산성 양성자에 대한 EDG의 위치는 그 효과에 영향을 미칩니다. 산성 양성자에 더 가까운 EDG는 더 큰 영향을 미칩니다.
더 구체적인 예를 원하거나 더 이상 질문이 있으면 알려주세요!