전자 구성 이해
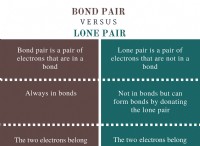
* 전자 쉘 : 전자는 전자 쉘이라는 특정 에너지 수준을 차지합니다. 이 쉘은 1, 2, 3 등으로 번호가 매겨지며 더 높은 숫자는 더 높은 에너지 수준을 나타냅니다.
* 서브 쉘 : 각 쉘 내에서, 전자는 서브 쉘로 추가로 정리된다. 4 개의 주요 서브 쉘은 s, p, d 및 f로 지정됩니다.
* 궤도 : 각 서브 쉘에는 하나 이상의 원자 궤도가 포함되어 있으며, 이는 전자를 찾을 확률이 높은 공간의 영역입니다.
탄소의 전자 구성
* 원자 번호 : 탄소의 원자 수는 6인데, 이는 6 개의 양성자와 6 개의 전자가 있음을 의미합니다.
* 전자 구성 : 탄소의 전자 구성은 1S² 2S² 2p²입니다. 분해합시다 :
* 1s² : 두 개의 전자는 1s 서브 쉘 (가장 낮은 에너지 수준)을 차지합니다.
* 2S² : 두 개의 전자가 2S 서브 쉘 (다음 에너지 수준)을 차지합니다.
* 2p² : 두 개의 전자는 2P 서브 쉘 (두 번째 에너지 수준)을 차지합니다.
전자를 찾을 수있는 곳
* 1s 서브 쉘 : 1s 서브 쉘의 두 전자는 핵에 가장 가깝게 발견됩니다.
* 2s 및 2p 서브 쉘 : 2S 및 2P 서브 쉘의 4 개의 전자는 두 번째 전자 쉘에서 핵에서 더 발견된다.
요약 :
* 2 전자는 첫 번째 쉘에 있습니다.
* 4 개의 전자는 두 번째 쉘에 있습니다.